南京市2006年中考文化考试化学试卷(模拟三)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共80分.考试时间100分钟。
第Ⅰ卷(选择题共25分)
一、选择题(每题只有1个选项符合题意,每题1分,共15分)
1.可能是化学变化的现象是( )。
A. 升华 B. 燃烧 C. 爆炸 D. 液化
2.下列选项中物质的名称、俗名、化学式一致的是( )。
A. 二氧化碳 冰 CO2 B.氢氧化钙 熟石灰 Ca(OH)2
C.氧化钙 石灰石 CaO D.氧气 臭氧 O3
3.同种元素的原子和离子一定具有相同的( )。
A. 电子数 B. 质子数 C. 电子层数 D.最外层电子数
4.下列粒子中属于阴离子的是( )。
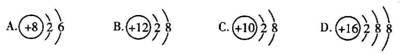
5.下列实验操作错误的是( )。

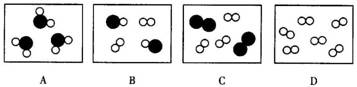
6.如图所示,图中●和○分别表示两种不同质子数的原子,其中表示化合物的是( )。
7.氢氧化钾是我国古代纺织业常用的洗涤剂,古人将贝类(主要成分为碳酸钙)灼烧后的固体与草木灰(主要成分为碳酸钾)在水中相互作用,就生成了氢氧化钾。上述叙述中没有涉及到的化学反应类型是( )。
A. 化合反应 B.分解反应 C. 置换反应 D.复分解反应
8.安全生活离不开化学。下列说法错误的是( )。
A. 工业酒精中含有甲醇等有害物质,不能饮用
B.工业用盐亚硝酸钠对人体有害,不能用于烹饪
C. 进入久未开启的菜窖、干涸的深井和深洞前,要做灯火实验
D.发现煤气泄漏,应立即打开排气扇电源开关排气
9.下面是王小莉同学用连线的方式对某一主题知识进行归纳的情况,其中有错误的一组是( )。
| 活性炭有吸附性——作净水剂 氢气有还原性——冶炼金属 乙醇有可燃性——用作燃料 |
A. 性质与用途
B. 安全常识
|
|
| 溶洞探险——须做灯火实验 煤气泄露——严禁火种 稀释浓硫酸——水倒入浓硫酸中 |
C. 元素与人体健康
|
|
| 人体缺碘——甲状腺肿大 人体缺钙——易患佝偻病 人体缺铁——易患贫血症 |
D. 环保与物质的利用
| 减少酸雨的发生——使用新型能源 减少汽车尾气污染——使用乙醇汽油 减少水污染——使用无磷洗衣粉 |
11.某些食品包装袋内常有一小包物质,用来吸收氧气和水分,以防止食品腐败,常称“双吸剂”。下列物质属于“双吸剂”的是( )。
A. 炭粉 B.铁粉 C. 氯化钙 D.生石灰
12.按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径。姜宇同学在家中建立了小小化学实验室,他收集了许多物质,其中有:①纯碱;②生石灰;③醋酸;④熟石灰;⑤酒精;⑥铜;⑦石墨;⑧氧化铁;⑨蔗糖;⑩尿素。对上述物质的分类不正确的是( )。
A. 属于有机物的有③⑤⑨⑩ B.属于单质的有⑥⑦
C.属于碱的有①④ D.属于氧化物的有②⑧
13.牙膏配料氟化物添加剂可以防止龋齿的原因是在牙齿表面生成一层质地坚硬的氟酸钙。已知
氟酸钙化学式中除钙离子外,还含有3个PO43—和1个F—,则其化学式是( )。
A.Ca5(PO4)3F B.Ca3(PO4)3F C.Ca2(PO4)3F D.Ca6(PO4)3F
14.在A+2B===C+3D的反应中,4gA与2gB恰好完全反应,生成lgC,若D相对分子质量为80,则B的相对分子质量为( )。
 A.16 B.32 C.48 D.96
A.16 B.32 C.48 D.96
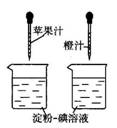
15.用右图实验可以测定果汁中维生素C含量的多少。要得出正确结论,
实验过程中不需要进行控制的条件是( )。
A. 烧杯的大小
B.烧杯中的淀粉——碘溶液的质量
C. 胶头滴管滴出的每滴果汁的体积
D.胶头滴管滴出的果汁的滴数
二、选择题(以下各题,有一个或二个符舍要求的答案。错选、多选不给分。有二个答案的,只选一个且正确,给1分。每题2分,本题共10分)
16.下列各组有机物两者间分别完全燃烧,得到二氧化碳与消耗氧气的质量比相同的一组是( )。
A.CH4和C2H4 B.CH4和CH3OH C. CH4和C2H5OH D.C2H4和C2H5OH
17.在饱和Ca(OH)2溶液中,放入少量CaO粉末,恢复至原温度后,没发生变化的是( )。
A. pH B.溶液质量 C.溶质质量分数 D. 溶剂的质量
18.实验测得某化肥硝酸铵(NH4NO3)样品中氮的质量分数为37%,则该化肥中可能混入的一种氮肥是( )。
A.NH4HCO3 B.CO(NH2)2 C.(NH4)2SO4 D.NH4C1
19.不同质子数、相同电子数的两种粒子可能是( )。
A.同一元素的不同离子 B.不同元素的离子
C一种元素的原子和另一种元素的离子 D.不同元素的原子
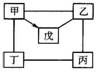
20.下图中“一”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化为戊。下面四组选项中,符合右图要求的是( )。
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | A1 | H2SO4 | NaOH | CuCl2 | A12O3 |
| B | HCl | Zn | H2SO4 | Fe | CuCl2 |
| C | C | CuO | HCl | O2 | CO |
第Ⅱ卷(非选择题 共55分)
三、填空题(每空1分,共20分)
2l. 请将下列物质按照一定的要求从大到小(由高到低、由多到少)排列(填序号)。
(1)相对分子质量:①二氧化碳 ②氢气 ③氮气 。
(2)硫元素的化合价:①SO2 ②Na2SO4 ③H2S 。
(3)溶解性:①CuO ②Ca(OH)2 ③KNO3 。
(4)溶液的pH:①NaCl溶液 ②Na2CO3溶液 ③CH3COOH溶液 。
(5)地壳中元素含量:①Ca ②A1 ③Si 。
(6)用量筒量取m mL溶液的取液量:①仰视刻度线读出读数 ②俯视刻度线读出读数
③平视刻度线读出读数 。
22.具有如下结构的粒子中:
![]()
(1)属于同种元素的是 ; (2)属于稳定结构的是 ;
(3)属于阳离子的是 ; (4)化学性质相似的是 ;
(5)属于金属元素的是 ; (6)能形成AB型化合物的是 。
23.随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的几个问题。
(1)植物为人类提供了大量营养物质,某些儿童由于偏食(不爱吃蔬菜、水果),结果生长发育出现障碍,患营养缺乏症,这些病症曾成为医学难题。这是由于摄入 (选填:A. 维生素 B.油脂 C. 蛋白质)不足而引起的。
(2)微量元素与人体健康密切相关,若膳食不合理,摄入某种微量元素不足,就会引起疾病。下列元素中不属于人体必需的微量元素的是 (选填:A. 锌 B. 氮 C. 铜
D.汞 E铁 F. 碘)。
(3)人体摄入过多食物时,会引起过多胃酸分泌,胃液的pH下降,使人体感到不适,此时服用消酸剂能有效调节胃内的pH,双羟基铝酸钠就是一种常用消酸剂,其化学式为NaAl(OH)2CO3,它的相对分子质量为 。由于Al3+在人体内难以代谢,含量高了就会造成许多疾病,如老年痴呆症。请再举生活中—例,说明铝元素是如何进入人体的 。
(4)下表是某食品包装上的说明。从下表的配料中分别选出一种物质,填在相应的横线上。富含蛋白质的是 ,富含糖类的是 ,富含油脂的是 ,富含维生素的是 。
| 品名 | X X X |
| 配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁 |
| 生产日期:标于包装袋上 | |
四、有关金属材料的探究(共35分)
24.人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(1)以下工具的制作过程中没有发生化学变化的是( )。
A. 原始人制作石刀 B.冶炼青铜 C. 炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序 (填序号)。
A. 铁 B.青铜 C.铝
从以上顺序可以看出,金属制品的出现顺序与 有关,那么金属钾的制得应排在
之后。
(3)金属区别于非金属的主要物理性质是,金属具有 ,金属区别于非金属的主要化学特征是 。在化学变化中金属原子通常表现为 。
(4)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3△2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:
(5)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”。
①请你用学过的知识回答,真的可以“炼石成金”吗?
②那么你认为这金光灿灿的金属是什么?它是怎么炼出来的?写出有关化学方程式。
该金属可能是 ,炼出它的化学方程式为 、
、 。
(6)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理: 。
(7)磁悬浮的核心技术得制备超导材料。有一种超导材料的化学式为Y2BaCu6O10,它是以YmOn、BaCO3和CuO为原料经研磨烧结而成。假设此过程中所有元素的化合价不变,试填写以下空白:
a. 超导材料Y2BaCu6O10是由 种元素组成的,YmOn的化学式是: 。
b.在合成该超导材料的同时还生成—种产物,该物质是 (写化学式)。
金属的使用及冶炼历史也引起同学们极大兴趣,初三同学组织化学兴趣小组继续进行(8)(9)探究:
(8)首先他们收集大量有关钢铁的成语与民间谚语。其中有说明钢的性能比铁好的有
,知道“百炼成钢”是指铁在高温条件下反复敲打发生的反应是:
,从而了解钢与铁的机械性能不同是因为两者 。
(9)钛(Ti) 因为具有许多神奇的性能而越来越引起人们的关注。化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究。
[提出假设] a. Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间。
[查阅资料] 在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强。
[实验设计] 同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象。
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 。
[实验现象]
| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
[实验结论] 原假设中 不正确,理由是 。
[结论] 用不同浓度的足量稀盐酸反应,是否也能得出同样结论? ,请说明理由
(10)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验
结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图像(如图所示)。

两个图像中存在有错误的是 的图像,判断错误的理由是 ,
图像不同的原因是 。
由该实验可以得到的结论:
①金属与酸反应的速率与 有关。
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与 有关。(11)将铁粉加到一定量的硝酸银、硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,在滤液中
滴加盐酸,没有白色沉淀生成,则滤渣中一定有 ,肯定滤液中有 。
(12)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一
种,现欲测定其组成。
[查阅资料] Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn—65,Sn一119,Ni一59。
[实验步骤及数据] 取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次 数 | l | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
试求:①合金中铜的质量分数。②合金中另一金属为何种金属。
南京市2006年中考文化考试化学试卷(模拟三)
1.C 2.B 3.B 4.D 5.A 6.A 7.C 8.D 9.B 10.A 11.B 12.C 13.A 14.C 15.A
16.D 17.A、C 18.B 19.B、C 20.A、B
21. (1)①③② (2)②①③ (3)③②① (4)②①③ (5)③②① (6)①③②
22.(1)③⑤ (2)①②⑤ (3)① (4)③⑥ (5)①④ (6)①⑤
23.(1)A (2)B、D (3)144 铝合金饮料包装(糖果铝膜包装)及食品添加剂、净水剂,如明矾
(4)鸡蛋(奶粉) 面粉(白砂糖) 植物油(奶油) 柠檬汁
(以下每空1分)
24.(1)A (2)B、A、C 金属活动性 C
(3)金属光泽,良好的传热导电性、延展性 易失去电子
(4)2CuO+2C===2Cu+CO2↑
(5)不能,在化学变化过程中元素种类不可能发生改变 铜锌合金 ZnCO3=== ZnO+CO2↑ 2ZnO+C===2Zn+CO2↑ 2Cu2O+C==4Cu+CO2↑
(6)Fe+CuSO4==Cu+FeSO4
(7)四 Y2O3 CO2 (8)恨铁不成钢 C+O2===CO2 含碳量不等
(9)除去氧化膜利于直接反应
a 镁反应速率比钛快 否 反应速率与反应物浓度有关
(10)小红 图像中Fe与Zn标反了,Zn的反应速率较Fe快 小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完 ①金属活动性 ②相对原子质量
(11)Ag Zn(NO3)2、Fe(NO3)2
(12)①64% ②另一种金属为锌。