专题复习 化学计算
(注:* 表示适合新教材所用)
一、有关化学式的计算
1、计算物质的式量(摩尔质量)
根据物质的化学式计算它的式量:
* 摩尔质量的数值与该物质的式量数值相等,单位为:g / mol
例1 硝酸铵的式量为___________。
*摩尔质量为__________________。
胆矾的式量为____________。
*摩尔质量为_________________。
2、计算原子个数比:(物质的量之比)
根据化学式计算分子中原子的个数之比。(原子个数之比就等于物质的量之比)。
例2 酒精(CH3CH2OH)分子中各原子的个_________________。
*酒精(CH3CH2OH)分子中各原子物质的量比是__________________。
3、计算化合物中各元素的质量比。
化合物中各元素的质量比,既等于化合物中各元素的原子个数比乘以该原子的相对原子质量的最简比。
例3 碳酸氢铵中各元素的质量比______________________。
4、计算化合物中各元素的质量分数
(1)根据化合物的化学式计算化合物中各元素的质量分数。
例: 计算硝酸铵中氮元素的质量分数________________。
(2)根据化合物的质量,求它们所含元素的质量
例: 64克二氧化硫中硫元素的质量为___________克。80克三氧化硫中氧元素的质量为_________克。M克二氧化硫与N克三氧化硫含相同质量的硫元素,则M ________N ( 填 < = > )。
(3))根据化合物中某元素的质量,求相应的化合物的质量
例:如果服用碳酸钙补钙,那么补钙0.5g 钙元素,需碳酸钙________克。
**二、有关物质的量的计算
A . 物质的量与微粒数的关系

例: 2 mol 二氧化碳含分子数________________个,含碳原子________mol ,含氧原子__________________个。
B.
 物质的量、质量和摩尔质量之间的关系
物质的量、质量和摩尔质量之间的关系
例:3 mol 水为__________克,80克氢氧化钠是________摩尔。
0.2 mol Na2SO4与_________mol KNO3含氧原子个数相同。
三、有关化学方程式的计算:
关键:①正确写出反应的化学方程式。
②明确化学方程式所表示出的化学反应中物质之间的质量(物质的量)关系。
③明确反应物与生成物之间的质量比(物质的量之比)。
④列出正确比例,根据格式求解。
注** 气体质量跟气体体积的换算: ρ= m / V (g / cm3)
1、有关反应物、生成物的计算:
例:将11.2克铁粉与足量的盐酸起反应,能生成氢气多少克?这些氢气在标准状况下的体积是多少升?(标准状况下,氢气密度为0.09克/升)
**制取1mol 氧气,需要氯酸钾_________mol,需要过氧化氢___________mol 。
2、有关含有一定量杂质的反应物或生成物质计算:
关键:化学方程式表示的是化学反应是纯净物之中的质量关系,若反应物或生成物含有杂质——不纯,必须换算成纯净物的质量,然后再进行计算。
例1:高温煅烧450吨石灰石,其中CaCO3的质量分数为90%,问可得到质量分数为95%的生石灰(主要成分为CaO)多少吨?
**氯化钠和碳酸钠的混合物50克与足量的硫酸反应,生成二氧化碳0.2 mol ,则氯化钠在混合物中的质量分数为______________。
四、有关溶液的计算:
1、有关溶解度S的计算
(1)计算溶解度S 单位:(克 / 100克水):已知饱和溶液的质量(或溶剂的质量)和溶质的质量,求溶解度。
注** 根据溶解度图形表、图形信息计算
 关于溶解度的计算,要掌握以下关系:
关于溶解度的计算,要掌握以下关系:
①
②几种比例关系:
溶质质量∶溶剂质量 = 溶质质量¢∶溶剂质量¢
溶质质量∶溶液质量 = 溶质质量¢∶溶液质量¢
溶剂质量∶溶液质量 = 溶剂质量¢∶溶液质量¢
例1、在10℃ 时,有一杯氯化铵饱和溶液100克中,含有水是75克,则此时氯化铵的溶解度是__________________。
(2)已知溶解度,计算溶质、溶剂或饱和溶液的质量
掌握溶解度的概念,利用正比例关系,对饱和溶液中的溶质,溶剂和溶液的质量进行计算;或反过来求物质的溶解度。
例2、60℃时,硝酸钾的溶解度是110 g /100g水。(1)150克水中最多可溶解硝酸钾固体多少克?(2)150克硝酸钾固体能配成多少克硝酸钾饱和溶液?需水多少克?(3)150克饱和硝酸钾溶液中含有硝酸钾固体和水各多少克?
2、有关溶液中溶质的质量分数(质量百分比浓度C%)的计算
(1)![]()
例1、将30克硝酸钾放入100克水中,完全溶解,所得溶液的质量分数是_____________,在上述溶液中再加入30克硝酸钾,有10克未溶解,所得溶液的质量分数是___________,若将温度升高,10克未溶解的固体也全部溶解,则所得溶液的质量分数是_____________。
例2、 医疗用的生理盐水是0.9 %的氯化钠溶液。若给病人输入1000克生理盐水,则有__________克氯化钠和_________毫升水进入病人体内。
(2)掌握溶解度和饱和溶液中溶质的质量分数(质量百分比浓度C%)的换算:![]()
例:某物质的水溶液,蒸发掉10克水后,冷却到20℃,有晶体析出,此时溶液中溶质的质量分数为30%,求20℃时该物质的溶解度________________。
(3)溶液质量跟溶液体积的换算 :ρ= m / V ( g / mL)
例:50 mL质量分数为98%的硫酸溶液中含硫酸_________克,含有水_________mL。(ρ硫酸 =1.84 g/mL ρ水 = 1.0 g/mL )
(4)溶液的配制和稀释计算:
![]()
m稀 = m浓+ m 水
例1:将质量分数为60%的氢氧化钠溶液配制成质量分数为40%的氢氧化钠溶液1500克,需要质量分数为60%的氧氧化钠溶液及水各多少克?
例2:用100毫升质量分数为98%的浓硫酸溶液(其密度为1.84克/cm3)和116毫升的水配制成的溶液密度为1.50克/cm3。求:
①配制成的硫酸溶液中H2SO4的质量分数是多少?
②配制成后的溶液的体积是多少?
化学计算的训练
一、选择题(每小题有一个正确答案)
1、在五氧化二磷里磷元素与氧元素的质量比为 ( )
A.31∶40 B.62∶40 C.31∶80 D.31∶16
2、下列算式计算正确的是 ( )
A.Na2CO3的相对分子质量 = 23×2+12+10(1×2+16)
B.CuSO4的相对分子质量 = 64 + 32 + 16 + 4
C.(NH4)SO4中N的质量分数![]()
D.CO(NH2)2中N的质量分数![]()
3、CuSO4·5H2O晶体中,结晶水的质量分数是 ( )
A.48% B.84% C.63% D. 36%
4、t℃时,某物质的饱和溶液中溶质的质量分数为30%,该物质在t℃时的溶解度为 ( )
A.23.1克/100克水 B.42.9克/100克水
C. 30克/100克水 D.75克/100克水
5、下列化合物中含氮最高的是 ( )
A.NH4HCO3 B.NH4NO3 C.NH4Cl D.CO(NH2)2
6、将300克质量分数为90%的硫酸稀释成质量分数为60%的硫酸,需要加水的质量为 ( )
A.160克 B. 200克 C.250克 D. 150克
7、已知反应:![]() 。当10克A物质与5克B物质恰好完全反应时,生成9克C物质。若需要生成3克D物质,则最少需要A物质的质量是
( )
。当10克A物质与5克B物质恰好完全反应时,生成9克C物质。若需要生成3克D物质,则最少需要A物质的质量是
( )
A.12克 B.8克 C.5克 D.6.3克
8、硫酸铜溶液与氢氧化钠溶液完全反应,两种溶液里含溶质的质量比为 ( )
A.1∶6 B.1∶2 C.2∶1 D.6∶1
9、9克某金属R与足量的稀盐酸反应,生成RCl3和1克氢气,那么金属R的相对原子质量为 ( )
A.18 B.9克 C.27 D.50克
10、实验室用8克高锰酸钾装入试管加热制取氧气,反应后称量得剩余固体物质2.2克。那么剩余物质是 ( )
A.KMnO4 B.KMnO4和K2MnO4
C.MnO2,KMnO4和K2MnO4 D.MnO2和KMnO4
11、某物质在t℃时的溶解度为25克,t℃时该物质80克饱和溶液中含溶质的质量为 ( )
A.20克 B.16克 C.30克 D.40克
12、使一氧化碳和氢气分别与足量的氧化铜在加热的条件下充分反应,如果要使生成的铜的质量一样多,那么消耗一氧化碳和氢气的质量比应该是 ( )
A.1∶1 B.14∶1 C.1∶14 D.2∶1
13、某元素R与氢的化合物(RH4)中氢的质量分数为25%,则R的相对原子质量为 ( )
A.28克 B.12克 C.28 D.12
14、氯化钡溶液32.22克与20克硫酸溶液恰好完全反应,经过滤得到盐酸溶液50克,那么盐酸溶液中溶质的质量分数为( )
A.1.4% B.29.8% C.35.6% D.16.7%
*15、中和一定质量和一定浓度的稀硫酸,需要用X mol氢氧化钠,若改用A mol的氢氧化钾,则反应后溶液的pH 应当是 ( )
A.等于7 B. 大于7 C. 小于7 D. 无法确定
*16、等物质的量的下列物质在足量的氧气中完全燃烧,消耗氧气最少的是 ( )
A. C B. CO C. CH4 D. CH3CH2OH
*17、下列关于0.5molH2SO4的说法正确的是 ( )
A.含0.5mol氢分子 B.含有2个氧原子
C.含6.02×1023个H2SO4分子 D.质量为49克
二、填空题
1、“沙林”是剧毒的神经毒剂,其化学式为C4H10O2F,它是由________种元素组成,每个“沙林”分子中含有_________个原子,式量是__________,各种原子的个数比C:H:O:F=____________,
(0.1mol“沙林”的质量为___________g,其中含有___________
______________个氢原子。)
2、有某氧气和二氧化硫的混合气体,其氧元素的质量百分含量为60%,则该气体中氧气与二氧化碳的质量比为________________。
3、Fe2O3 中铁元素与氧元素的质量比为_____________。要生产525吨铁,至少需含Fe2O3 75% 的赤铁矿石____________吨。
4、20℃时硝酸钾的溶解度为36克/100克水,若该温度时把80克硝酸钾放入200克水中,所得溶液的质量为____________克,此时溶液中溶质的质量分数为______________。
5、将3克A物质在氧气中充分燃烧,生成8.8克二氧化碳和5.4克水,由此可推断该物质中含有________元素;将4.6克B物质在氧气中充分燃烧,也生成8.8克二氧化碳和5.4克水,则B物质中氧元素的质量百分含量是______________。
*6、(1)1molN2与1molCO2相比,所含分子数之比__________,原子数之比____________。
(2)与49克硫酸具有相同分子数的水是_________克,与49克硫酸具有相同氧原子的水是_________克。
*7、制取相同物质的量的氧气,需要氯酸钾与过氧化氢的物质的量之比是__________,质量之比是_______________。
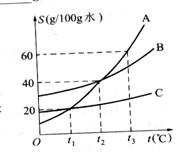 8、右图是A、B、C三种物质的溶解度曲线。请看图回答:
8、右图是A、B、C三种物质的溶解度曲线。请看图回答:
(1) 将t3℃时,A、B、C三种物质溶解度由大到小的顺序为_____________。
(2) ______℃时,A、C两物质溶解度相等。
(3) t2℃时,100g B物质饱和溶液的质量分数 _____________。
9、某正二价金属1.2克跟足量的盐酸反应,生成0.1克氢气,该金属的相对原子质量是_______________。
10、在空气中加热4.8克铜粉,使它全部变成氧化铜,然后把它放入足量的稀硫酸中,待反应完毕,再加热蒸发溶剂,可制得硫酸铜晶体的质量是________________。
三、计算题:
1、吸入“笑气”会使人发笑,该气体是由氮、氧两种元素组成的化合物,式量为44,氮、氧元素的质量比为7:4,则它的化学式为____________。
2、已知(硝酸钾的溶解度——10℃为21克;20℃为31.6克;60℃为108克;80℃为169克)
(1)把100克80℃时的硝酸钾饱和溶液冷却到20℃,能析出硝酸钾晶体多少克?
(2)把100克10℃时的硝酸钾饱和溶液升温到60℃,还能溶解硝酸钾晶体多少克?
3、将4克氢氧化钠加入到50克盐酸溶液中恰好完全反应。求:
①盐酸溶液中溶质的质量分数;
②生成氯化钠的质量。
4、有一碳酸钠溶液质量是12克,当加入50克盐酸溶液后恰好完全反应。已知盐酸溶液溶质的质量分数为14.6%,求反应后溶液中溶质的质量分数?
5、现有4.5克不纯的铁粉跟75克16%的硫酸铜溶液恰好完全反应(杂质不参加反应且难溶).计算:(1)铁粉含杂质的百分率。
(2)反应后溶液中溶质的质量分数。
*6、0.5mol的NaOH 放入95克的水中,充分溶解后所得溶液的质量分数是___________。
*7、将0.036mol碳酸钙高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的百分含量为57.6%,则剩余固体中氧化钙的质量分数是多少?