高考化学大预测卷
第一卷
一、选择题
1.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:
n(NO3-): n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
2.反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2Na1+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2………………(1)
2Na1O3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2………………(2)
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>SO42->IO3->I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1:5
3.某有机物A的分子式为C8H16O2,,可发生如下转化:
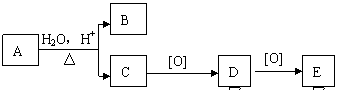 |
其中B与E互为同分异构体,则A可能的结构有:
A.1种 B.2种 C.3种 D.4种
| |
4.已知某温度下,N2(g)+3H2(g)≒ 2NH3(g);△H=-92.4 kJ/mol现有恒温、恒容且体积相
同的两个密闭容器A、B,A中通入1mol N2、3 mol H2,B中通入0.5 mol N2、1.5 mol H2,
反应一段时间后,测得两个容器中气体密度均不发生变化。下列判断正确的是
A.A中吸热92.4 kJ
B.B中吸热46.2 kJ
C.A中热量变化值一定大于B的2倍
D.A、B中平衡状态相同
5.几种短周期元素的原子半径和主要化合价见下表:
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | 十2 | 十3 | 十6、一2 | 十7、一1 | 十4、一4 | 一2 |
下述说法正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
6.在容积固定的密闭的容器中存在如下平衡:A(g)+3B(g)≒2C(g);△H<0,某研究小组研究了其它条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
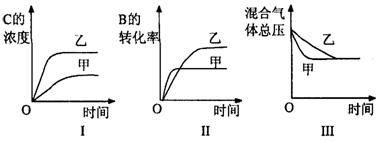
下列判断一定错误的是
A.图I研究的是不同压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
7.浓度都是1 mol·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中
c(x-)=1 mol·L-1,BX的溶液pH=4,BY的溶液pH=6。则AY的溶液pH为
A.大于7 B.等于7
C.小于7 D.无法判断
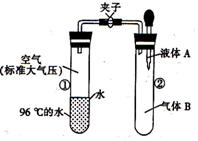 8.如图所示,夹子开始处于关闭状态,将液体A滴人试
8.如图所示,夹子开始处于关闭状态,将液体A滴人试
管②与气体B充分反应,打开夹子,可发现试管①内
的水立刻沸腾了。则液体A和气体B的组合不可能
是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
第二卷
二、主观题
9.Ⅰ、在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得如下数据:
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
请回答下列问题:
(1)上表中“待测数据”的数值是_______________,此密闭容器内反应类型属于_________________(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比是n(X):n(Y):n(Z):n(Q)
=2:4:4:1,写出化学反应方程式____________________________________。
(3)反应结束后若将反应体系内的Y物质取出,在标准状况下测定其体积小于11.2L,其原因是_________________________________________________________。
Ⅱ、A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出下列元素的元素符号:B ,D ;
(2)E的最高价态与A、B、C三种元素形成酸式盐Y的化学式是 ,该盐在水溶液中离子浓度由大到小的顺序是 。
(3)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,这两种溶液中由水电离出来的H+浓度之比为c(H+)1∶ c(H+)2 = 。
10.有机物A的相对分子质量184.5,其结构如图1所示,(-R-代表某种烷基),A在一定
条件下还有如图2所示的反应关系,D不能发生银镜反应。
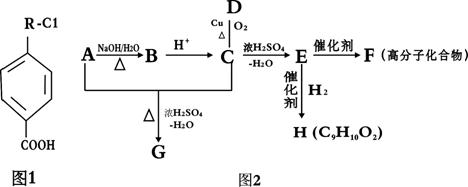
(1)C中含有的官能团为_____________________,E→F的反应类型为 ;
(2)写出A的结构简式______________________________;
(3)写出C→E的化学方程式 ;
(4)H的同分异构体很多,其中属于酯类,含苯环,且水解产物中含有乙酸的同分异构体
有 种
(5)G显酸性,M(B),M(G)分别表示B、G的相对分子质量,试求:M(G)-M(B)= 。
11.某些物质的转化关系如下图所示。其中甲可由两种单质直接化合得到;乙为金属单质,常温下,它在G的浓溶液中不溶解;F的溶液中只含一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。
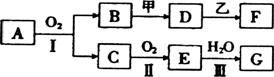 |
(1)若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。
① 写出B和甲反应的化学方式 。
② 1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式 。
③D与乙反应的离子方程式是 。
(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加人HNO3酸化的AgNO3溶液有白色沉淀生成,向F中加入过量的NaOH溶液,有沉淀产生。
① 工业上反应II在 中进行。
② D和乙反应的化学方程式是 。
③ B、D、F中含同一种元素,该元素在周期表中的位置是: 。
④写出由B为原料,得到该元素单质的化学方程式: __。
12、一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
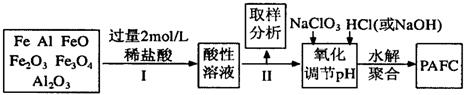
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有___________________。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)步骤I中加入过量稀盐酸的目的是________________________________________;
(3)下列关于PAFC的说法中正确的是( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH—,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(4)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3
D.测定溶液中Al3+的含量
(5)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________。
该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:
(6)测定时所需的试剂有__________________。
A.NH3·H2O B.NaOH C.CO2 D.NaCIO3
(7)测定时,直接测定的是____________和_____________的质量(填化学式)。
(8) 在测定过程中的操作顺序是______________________(按操作选择顺序选择填写)。
A.萃取 B.分液 C.过滤 D.蒸发
E.洗涤 F.称量 G.灼烧 H.冷却
参考答案:
6、此题要求学生不但从字面上了解化学反应速率及影响因素、化学平衡及影响因素,而且能结合图象和“特殊点”进行综合分析,为什么图I反映的是乙使用的催化剂效率高,图Ⅱ反映的是甲的压强较高?全面深刻地认识上面的概念和原理。 “欲速则不达”,要帮助同学仔细剖析三个图象的特点,横、竖坐标的含义,图形变化情况,再联系影响反应速率、化学平衡的因素,对照分析得出A、B答案。
9、 Ⅰ. [问题解析]
(1)定性分析表格中X、Y、Z、Q四种物质反应前后的质量关系,发现X、Q物质的质量增加,Z物质的质量减少,则X、Q为生成物,Z为反应物。定量分析X质量增加43.6-40.0=3.6(g)、Q质量增加3.2-0.0=3.2g,Z的质量减少37.8-12.6=25.2(g)。根据质量守恒定律,Y应为生成物,且质量增加为25.2-3.2-3.6=18.4(g)。 所以Y待测数据为18.4+4.6=23(g),因为反应物只有一种,则属于分解反应。
(2)若X是水,n(Z)=3.6g/18g/mol=0.2mol,则n(Y)=4n(Z)/2=0.4mol。n(Z)=n(y)=0.4mol,n(Q)=n(Z)/4=0.1mol。且M(Y)=18.4g/0.4mol=46g/mol,Y是氮的氧化物,则为NO2。M(Z)=25.2g/0.4mol=63g/mol,为硝酸。M(Z)=3.2g/0.1 mol=32g/mol,为O2。
(3)Y为NO2,它在标准状况下的体积为(23g×22.4L/mo1)/46g/mol=11.2L,现在体积小于11.2L是因为NO2与N2O4存在一个可逆平衡2NO2≒N2O4 使气体体积缩少。
答案: (1)21.4,分解 (2)4HNO3=4NO2↑+O2↑+2H2O
(3)因为2NO2≒N2O4存在的平衡,有部分NO2转化为N2O4使气体体积缩少。
Ⅱ、(12分) (1)B N ,D Na ;(各2分)
(2)NH4HSO4(2分)
c(H+)> c(SO42-)> c(NH4+)> c(OH-)(3分)
(3)102a-14(3分)
10.(16分)
(1)-OH、-COOH,(或名称)(2分) 加聚反应(或聚合反应)(2分)
(2)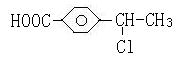 (3分)
(3分)
(3)(3分)
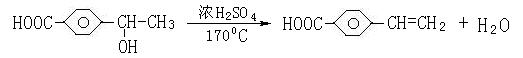
(4)4种 (3分)
(5)144.5(3分)
11、(16分)
(1)①2H2O+2Na2O2=4NaOH+O2↑ (2分)
② 4NH3(g)十5O2(g)=4NO(g)+6H2O(g);△H= -906.8 kJ·mol-1 (3分)
③ 2Al+2OH一十2H2O=2AlO2-+3H2↑ (3分)
(2) ① 接触室 (2分)
② 2FeCl3+Fe=3FeCl2(2分)
|
④Fe2O3+3CO=2Fe+3CO2(其它合理答案也给分)(2分)
12、解析:
本题以铁、铝及其化合物在实际生产生活中的应用为试题背景,不但涉及了铁、铝及其化合物的性质、盐类的水解、氧化还原反应等重要基础知识,而且还考查了一定物质的量浓度溶液的配制、定量测定、实验分析、基本操作等实验内容。充分体现了高考实验命题的特点,具有较高的综合性。
(1)配制一定物质的量浓度的溶液的主要步骤是:计算、称量(或量取)、溶解、定容。所以还需要的玻璃仪器有容量瓶、烧杯、胶头滴管。 (编者:对配置稀盐酸的浓度准确度要求不高,可用量筒和烧杯即可)
(2)原料(金属铁、铝及其氧化物)与稀盐酸反应后生成FeCl2、FeCl3、A1C13,均为强酸弱碱盐,能发生水解,加入过量稀盐酸能抑制Fe2+、Fe3+、A13+的水解。
(3)依据PAFC的化学式[AlFe(OH)nC16-n]m。可知是高分子化合物;Al的化合价为+3,OH的化合价为—1,Cl的化合价为—1,则依据“化合价代数和为零”的原则计算,Fe的化合价为+3;PAFC溶于水,电离出OH-和Cl-两种阴离子,所以不是碱;因为PAFC中有A13+和OH-,所以既能溶于强酸性溶液,也能溶于强碱性溶液。
(4)依据生产流程可知,步骤II中取样分析的目的与A、D选项无关;目的是测定溶液中Fe2+的含量,以确定氧化Fe2+所需NaClO3的量;而原料是否完全溶解,只需观察溶液是否澄清即可。
(5)依据生产流程可知,在酸性条件下,Fe2+被氧化为Fe3+,C1O3-被还原为Cl-,离子方程式为6Fe2++6H++C1O3-=6Fe3++Cl-+3H2O
(6)—(8)要测定Al和Fe的含量,应将Al3+和Fe3+转化为Al(OH)3和Fe(OH)3沉淀, 而Al(OH)3溶于强碱性溶液,所以应先加入过量的NaOH溶液,使Fe3+完全转化为Fe(OH)3沉淀,此时A13+完全转化为AlO2-,再向溶液中通人过量的CO2,使A1O2-完全转化为Al(OH)3;然后分别进行过滤、洗涤;而Al(OH)3和Fe(0H)3不稳定,干燥时易分解,则不能准确测定A1(OH)3和Pe(OH)3的质量, 所以应采取对Al(OH)3和Fe(OH)3进行加热灼烧,使其生成稳定的A12O3和Fe2O3,并准确测定其质量。
参考答案:
(1)ABD; (2)抑制Fe2+、Fe3+、A13+的水解;
(3)A D; (4)C; (5) 6Fe2++6H++C1O3-=6Fe3++Cl-+3H2O; (6)B C;
(7)Al2O3, Fe2O3;(8)CEGHF
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |