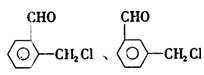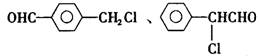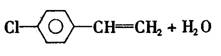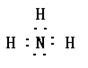高中毕业班化学质量检查试题Ⅳ
化 学 试 题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分108分,考试时间60分钟。
相对原子质量:H 1 C 12 N 14 O 16 C1 35.5 Mg 24 A1 27
6.下列关于40K和40Ca的叙述中正确的是 ( )
|
B.40K+和40Ca2+具有相同的电子层结构
C.39K和40K互为同素异形体
D.40K的原子半径小于40Ca的原子半径
7.下列离子方程式书写正确的是 ( )
A.Ca(OH)2溶液中通入过量CO2:Ca2++2C1O-+H2O+CO2
CaCO3↓+2HC1O
B.Ba(OH)2溶液中滴入NaHSO4溶液至恰好为中性:
2H++SO42-+Ba2++2OH-
BaSO4↓+2H2O
C.AgNO3溶液中滴入过量氨水:Ag++2NH3·H2O Ag(NH4)2++H2O
D.NaOH溶液中通入C12:2C12+2OH 3C1-+C1O-+H2O
8.反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4
2NaHSO4+MnSO4+2H2O+I2………………(1)
2NaIO3+5NaHSO3
2NaSO4+3NaHSO4+H2O+I2………………(2)
下列说法正确的是 ( )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>SO42->IO3->I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1:5
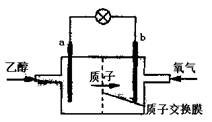
|
A.a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡到a极
C.电池正极的电极反应式为O2+2H2O+4e-
4OH-
D.电池工作时,1mol乙醇被氧化转移12mol电子
10.短周期元素A、B、C原子序数依次增大,A、C同主族,B原子的最外层电子数等于A原子最外层电子数的一半,且三种元素原子的最外层电子数之和为15。下列叙述正确的是( )
A.常温下B单质不与A单质反应
B.工业上采用热还原法冶炼B
C.A的氢化物的沸点高于C的氢化物
D.B是氧化物只能溶于酸
|
A.向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B.SO2、CH2 CH2都能使溴水褪色,但原理不同
C.NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D.FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
12.下列各组数据中,前者一定比后者大的是 ( )
A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-)
B.浓度均为0.1mol·L-1的(NH4)2SO4溶液和(NH4)2CO3溶液中的c(NH4+)
C.0.1mol·L-1的Na2CO3溶液中c(HCO3-)和c(OH-)
D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量
13.下表中的实验操作能达到实验目的是 ( )
| 选项 | 实验操作 | 实验目的 |
| A | 向沸腾的NaOH溶液中滴加FeC13饱和溶液 | 制备Fe(OH)3胶体 |
| B | 通入灼热的CuO粉后收集气体 | 除去N2中混有的少量O2 |
| C | 混合A12(SO4)3溶液和NaA1O2溶液 | 制备A1(OH)3沉淀 |
| D | C2H5Br和NaOH溶液混合后充分震荡再加入AgNO3检验C2H5的Br元素。 | 检验C2H5Br中的Br元素 |
2007年明珠学校高中毕业班质量检查Ⅳ
|
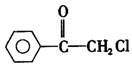
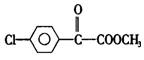
26.(14分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式为
(1)苯氯乙酮可能发生的化学反应类型有 (选填字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
|
反应这三个要求的苯氯乙酮的同分异构体有 、
、 。
|
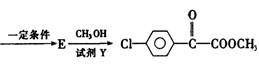
(3)已知:
苯氯乙酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂
|
|
|
请回答:
①M的结构简式为 ,D中含氧官能团名称为 。
②A→B的化学反应方程式为 。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5C1,则该产物的结构简式
为 。
|
请回答:
(1)实验室可用X的浓溶液制取Y,反应的化学方程式为 ;
若反应中转移0.05mol电子,则生成Y的体积在标准状况下为 ,被氧化的X的物质的量为 。
(2)向B溶液中滴加NaOH溶液并在空气中放置一段时间,此过程中的实验现象为 ,其中涉及到的氧化还原反应方程式
为 。
(3)A与过量的X溶液反应生成B的同时还有某种气体产生,为了减缓反应速率而不影响该气体的总量,可向X溶液中加入适量的 (选填字母)
a.CH3COONa(固) b. CuSO4(固) c.KNO3溶液 d.水 e.Na2SO4溶液
(4)C溶液与草酸(H2C2O4)反应,得到澄清溶液,同时生成一种能使石灰水变浑浊的
气体,此反应的离子方程为 。
|
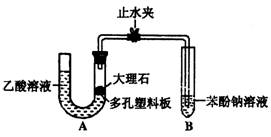
Ⅰ.探究乙酸、碳酸和苯酚的酸性强弱关系
该校学生设计了如下实验装置(夹持仪器已略去)。
(1)实验前如何检查装置A的气密性?
;大理石与乙酸溶液反应的化学方
程式为 。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为
,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是
,改进该装置的方法是 。
Ⅱ.证明乙酸为弱酸。
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:
。
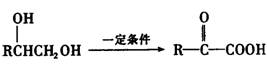
29.(15分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 。
实验室保存甲的方法是 。
|
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体
|
d.当X表示乙的物质的量时,Y表示某一
生成物的物质的量
(4)现有硫酸甲的混合液20mL,其中硫酸的物质的量浓度为2mol·L—1,甲的物质的量浓度为1mol·L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明)
。
化学试题参考答案
6.B 7.B 8.D 9.C 10.C 11.A 12.B 13.C
26.(14分,各2分)
(1)abd
|
(2)
|
(3)①
|
|
②
|
③
![]() 27.(16分,每空2分)
27.(16分,每空2分)
(1)(各2分)MnO2+4HC1(浓) MnC12+C12↑+2H2O;0.56L;0.05mol
(2)(各2分)生成白色累状沉淀,有空气中迅速变成绿色,最后变成红褐色;
4Fe(OH)2+O2+2H2O=4Fe(OH)2
(3)(3分)ade
(4)(3分)2Fe2++H2C2O2=2Fe2+2CO2↑+2H+
28.(15分)
(1)(3分)关闭止水夹,从左管向C型管内加水,至管液面高于右管,静置一段时间后,若U型管两侧液面差不发生变化,则气密性好(2分)CaCO2+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O
(2)(1分)试管内溶液出现浑浊;
|
|
(2分) —O-+CO2+H2O→ →OH+HCO3-
(3)乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚;(2分)装置A和B之间连接一个盛有饱和碳酸氢钠溶液的洗气瓶
|
29.(15分)
(1)(2分)
(2)(各2分)4HNO3 2H2O+4NO2↑+O2↑;贮存在棕色瓶中,置于冷暗处
(3)(2分)ab (4)(3分)224mL
![]() (5)(1分)促进;(3分)NH4++H2O NH3·H2O+H+,破坏了H2O的电离平衡,使H2O的电离平衡正向移动
(5)(1分)促进;(3分)NH4++H2O NH3·H2O+H+,破坏了H2O的电离平衡,使H2O的电离平衡正向移动