选择题训练(39)
一、选择题(每小题只有一个正确答案,每小题4分,8小题共32分)
1、FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,则HNO3的还原产物为
A、NO2 B、NO C、N2O D、N2O3
2、用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为
A、1 B、2 C、7 D、11
3、经测定,由C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数为
A、78% B、22% C、14% D、13%
4、有三种不同取代基-X,-Y,-Z,当它们同时取代苯分子中的3个氢原子,取代产物有
A、4种 B、6种 C、10种 D、14种
5、已知溶质质量分数为96%的酒精溶液的物质的量浓度为16.6mol/L,试判断48%的酒精溶液的物质的量浓度(mol/L)
A、大于8.3 B、等于8.3 C、小于8.3 D、无法确定
6.25℃时,在一定量饱和硫酸铜溶液里加入无水硫酸铜,其饱和溶液的质量和浓度的变化是
A.质量增大,浓度变大 B.质量减小,浓度变小
C.质量减小,浓度不变 D.质量增大,浓度不变
7. 能证明一各无色液体是纯净的水的方法是
A.电解该液体,得氢、氧两种气体,且氢气跟氧气的体积比为2:1
B.电解该液体,在阴极得到的气体体积为阳极气体体积的2倍
C.在1.01×105Pa测得其沸点是373K D.实验测得液体的pH=7
8. 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所
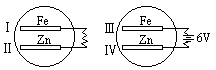 示),经过一段时间后,首先观察到溶液变红的区域是
示),经过一段时间后,首先观察到溶液变红的区域是
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.铋酸钠(NaBiO3)是一种强氧化剂.NaBiO3可将MnO42-氧化为MnO4-,同时要用浓硝酸酸化,但不能用浓盐酸酸化,这是因为:
A.硝酸是氧化性酸,其参加反应有助于将MnO42-氧化为MnO4-
B.硝酸的酸性比盐酸强 C.盐酸中的Cl-能被强氧化剂BiO3-氧化
D.NO3-离子催化NaBiO3时对Mn2+有氧化作用
10. 对于可逆反应中反应物的转化率的叙述中错误的是 BD
A. 同一反应中,达到平衡时,各反应物的转化率不一定相等
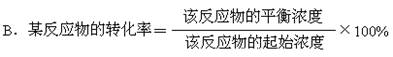 |
C.反应物的转化率大小可表示可逆反应进行的程度
D.在同一反应中,反应达到平衡时转化率一定大于未达到平衡时的转化率
11. 下表给出几种氯化物的熔点和沸点
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 190 | -68 |
| 沸点(℃) | 1465 | 1418 | 57 |
关于表中所列四种氯化物的下列说法:①氯化铝在加热时升华,②四氯化硅晶体属于分子晶体,③1500℃时氯化钠的分子组成可用NaCl表示,④氯化铝晶体是典型的离子晶体,其中与表中数据一致的是:
A.只有③ B.只有①和② C.只有①②③ D.全都一致
 12. 氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生.下列叙述不正确的是
12. 氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生.下列叙述不正确的是
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大 D.NH4H溶于水后,形成的溶液显酸性
13.下列物质没有固定的熔沸点的是
A.氯化钾 B.五氧化二磷 C.玻璃 D.盐酸
14、已知某饱和溶液的:①溶液的质量 ②溶剂的质量 ③溶液的体积
④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度
从以上条件的组合上,不能用来计算该饱和溶液的物质的量浓度的是:
A.①④⑥ B.④⑤⑥ C.①②③④ D.①③④⑤
15、草酸(H2C2O4)溶液与酸性KMnO4溶液反应,在两溶液混和时看不到明显现象,但过一段时间后,混和溶液突然迅速褪色,此反应的化学方程式为:
2KMnO4 + 3H2SO4 + 5H2C2O4 === K2SO4 + 2MnSO4 + 10CO2 + 8H2O,
据你的分析,突然褪色的原因可能是:
A.溶液已混和均匀了 B.反应中溶液酸性减弱
C.生成微量的Mn2+起催化作用 D.增大了外界的压强
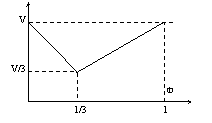 16、某链烃在一定条件下可和H2发生反应,取不同体积比的CnHm与H2(两者的体积和为定值V)在一定条件下反应,V与Φ(CnHm)、[CnHm的体积分数]的关系如图。则m和n的关系是:
16、某链烃在一定条件下可和H2发生反应,取不同体积比的CnHm与H2(两者的体积和为定值V)在一定条件下反应,V与Φ(CnHm)、[CnHm的体积分数]的关系如图。则m和n的关系是:
A.m=2n+2 B.m=2n
C.m=2n-2 D.m=2n-6
17、100℃时,Kw=10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是
A、11 : 1 B、9 : 2 C、12 : 11 D、9: 1
18、等量NaOH分别用pH=2和pH=3的醋酸中和,消耗二者的体积依次为Va和Vb,则Va和Vb的关系为
A、Va = 10Vb B、Va < 10Vb C、Va >10Vb D、 Vb >10Va