高考化学1月模拟考试试题
化 学 试 卷
说明:
1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分为150分,考试时间为120分钟。
2、请将第Ⅰ卷各题答案填涂在答题卡上,第Ⅱ卷各题答案填写在答题纸上相应位置。试题答案直接填在试题卷上无效。
3、可能用到的相对原子质量:H—1,C—12,N—14,O—16,F—19,Na—23,Mg—24,Al—27,
S—32,Cl—35.5,K—39,Fe—56,Cu—64, Ba—137
第Ⅰ卷(选择题,共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
2.化学与科技、社会、生产密切结合,下列做法合理合法的是
A.汽油中添加乙醇制备“乙醇汽油”,可有效减少有害气体的排放
B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观
C.化妆品中添加含铬物质制美白润肤“SK-Ⅲ”,可使女性青春永驻
D.汽水中添加林丹、毒死蜱和七氯等杀虫剂制“××可乐”,以增强口感和余味
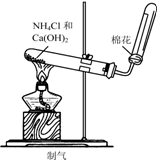
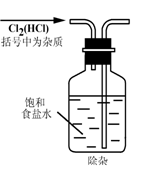
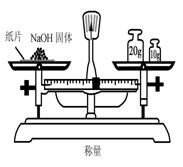 3.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
3.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
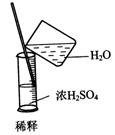
A. B. C. D.
4.X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2、②X2YZ3、③X2YZ2、④X2Y2Z4、⑤X3YZ4、⑥XYZ3,其中可能存在对应物质的是
A.①②④⑤ B.①②③④ C.②③④ D.②⑤⑥
5.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl—、Na+、K+、NO3—、OH—、S2—、MnO4—、Fe3+、NH4+、H+、SO42—、CO32—、AlO2—。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.MnO4—、SO42—、NO3— B.OH—、S2—、CO32—
C.Cl—、NO3—、SO42— D.AlO2—、MnO4—、SO42—
6.有一溶液中含有的溶质是NaOH、NaHCO3、Na2CO3中的一种或两种。现取等体积的两份上述溶液分别以酚酞和甲基橙做指示剂,用同样浓度的盐酸进行滴定,当达到终点时,消耗盐酸的体积分别为V1和V2,如果V2>2V1,则上述溶液中的溶质是
A.NaHCO3 B.Na2CO3 C.Na2CO3 和NaHCO3 D.NaOH和 Na2CO3
7.下列实验中,仪器的下端必须插入液面下的是:①制备氢气的简易装置中的长颈漏斗;②制备氯气装置中的分液漏斗;③制备Fe(OH)2操作中的胶头滴管;④制乙酸乙酯时插入碳酸钠溶液中的导管;⑤用乙醇制取乙烯时的温度计;⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
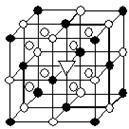 8.冰晶石(化学式Na3AlF6)的结构单元如右图所示,已知冰晶石熔融
8.冰晶石(化学式Na3AlF6)的结构单元如右图所示,已知冰晶石熔融
时电离方程式为:Na3AlF6 ===3Na++AlF63—。(● 位于大立方体顶点
和面心,○ 位于大立方体的12条棱的中点和8个小立方体的体心)
那么大立方体的体心处 ▽ 所代表的微粒是
A.Na+ B.Al3+ C.F— D.AlF6—
9.Co3+的八面体配合物(配位数为6)CoCl m· n NH3,若1 mol 该配合物与AgNO3 作用生成 1 mol AgCl 沉淀,则m、n的值是
A.m=1、n=5 B.m=3、n=4 C.m=4、n=5 D.m=5、n=1
|
| |
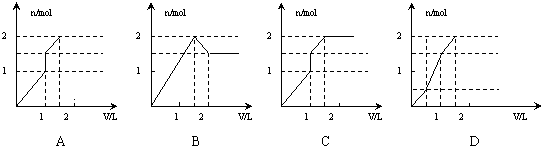 |
10.向含1 mol HCl和1 mol MgSO4的混合溶液中加入1mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
二、选择题(本题包括8小题,每小题4分,共32分,每小题有一个或两个选项符合题意,若正确答案是包括一个选项,多选时该题为0分;如果正确答案包括两个选项,只选一个且正确的可得2分,但只要选错一个,该小题就为0分)
11.设NA表示阿伏加德罗常数,下列叙述中,正确的是
A.常温常压下,16 g O2和O3的混合物中共含有NA个氧原子
B.假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78 g Na2O2固体中所含阴、阳离子总数为4 NA
D.在铜与硫的反应中,1 mol铜原子参加反应失去的电子数为2 NA
12.相互反应时,无论何种试剂过量离子方程式都正确的是
![]() A.盐酸与NaAlO2溶液:AlO2—+H++H2O Al(OH)3↓
A.盐酸与NaAlO2溶液:AlO2—+H++H2O Al(OH)3↓
![]() B.石灰水与磷酸二氢钠溶液:2H2PO4—+3Ca2++4OH— Ca3(PO4)2↓+4H2O
B.石灰水与磷酸二氢钠溶液:2H2PO4—+3Ca2++4OH— Ca3(PO4)2↓+4H2O
![]() C.明矾溶液与小苏打:Al 3++3HCO3— Al(OH)3↓+3CO2↑
C.明矾溶液与小苏打:Al 3++3HCO3— Al(OH)3↓+3CO2↑
![]() D.硫酸氢钠溶液和氢氧化钡:SO42—+2H++Ba2++2OH— BaSO4↓+2H2O
D.硫酸氢钠溶液和氢氧化钡:SO42—+2H++Ba2++2OH— BaSO4↓+2H2O
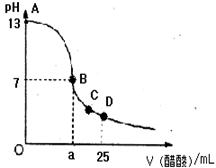 13.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
13.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有:
c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
B.在B点,a >12.5,且有:
c(Na+)=c(CH3COO—)=c(OH—)=c(H+)
C.在C点:c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
D.在D点:c(CH3COO—)十c(CH3COOH)=2c(Na+)
14.下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对;Ⅱ对;有 |
| B | Cl2和SO2可混合漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对;Ⅱ错;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | I对;Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对;Ⅱ对;有 |
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),以下结论不正确的是
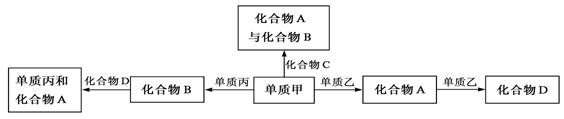
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
16.锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中形成的,以下电池的总反应方程式为:8Li+3SOCl2==6LiCl+Li2SO3+2S,下列
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2==6LiCl+Li2SO3+2S,下列
叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li 2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
17.工业上由二氧化锰制备高锰酸钾可分二步进行,
第一步:二氧化锰与氢氧化钾共熔并通入氧气 2MnO2+4KOH+O2==2K2MnO4+2H2O
第二步:电解锰酸钾溶液 2K2MnO4+2H2O===2KMnO4+H2↑+2KOH
下列说法叙述正确的是
A.该条件下氧化性:KMnO4 >K2MnO4 >O2
B.根据上述过程,每生成1 mol KMnO4共转移6 mol电子
C.第二步电解时,KMnO4在阳极区生成
D.第二步电解时阴极周围pH减小
 18.美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛,称为释迦牟尼分子。有关该有机分子的说法正确的是
18.美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛,称为释迦牟尼分子。有关该有机分子的说法正确的是
A.该有机物属于苯的同系物
B.1 mol该有机物完全燃烧需消耗25 molO2
C.1 mo1该有机物最多可以和10 mo1 H2发生加成反应
D.该有机物的一氯代产物的同分异构体有12种
19.甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3
![]()
![]() 催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如下图;目前正在开发的
催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如下图;目前正在开发的
新法是:2CH4+O2 2CH3OH。下列关于新法和旧法的说法正确的是
A.旧法生产中,CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是提高空气中氧气的转化率

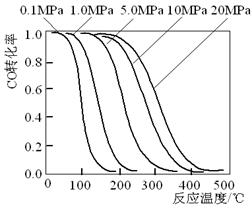
第19题图 第20题图
20.500℃、20Mpa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2
和NH3物质的量变化如图所示,下列说法正确的是
A.从曲线变化可以看出,反应进行到10 min至20 min钟时可能是使用了催化剂
B.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L· min)
C.从曲线变化可以看出,反应进行至25 min钟时,分离出0.1 mol的氨气
D.在25 min钟时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
第II卷(非选择题,共80分)
三、(本题包括3小题,共30分)
21(10分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
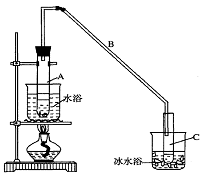
⑴制备粗品:将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢
加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________。
⑵制备精品:①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、
分层,环己烯在_____层(填上或下),分液后用______(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
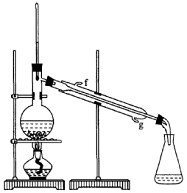 ②再将环己烯按右图装置蒸馏,冷却水从____口进入。蒸馏时要加入生石灰,目的是
。
②再将环己烯按右图装置蒸馏,冷却水从____口进入。蒸馏时要加入生石灰,目的是
。
③收集产品时,控制的温度应在_________左右,实验
制得的环己烯精品质量低于理论产量,可能的原因是 。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
⑶以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
22.(10分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”
(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人
 体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子
反应方程式是 , ;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为 ,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 ;
⑶该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为
该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答)
;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
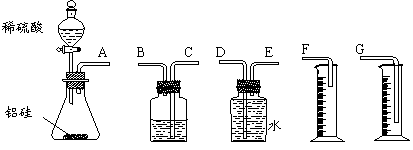
23.(10分)某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸
![]()
 的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
⑴甲组同学拟选用下列实验装置完成实验:
①该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填
接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能
顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?______________ _。
⑵乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,
也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存
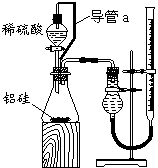 在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是__________________ _ _。
②实验中准确测得4个数据:实验前铝硅合金的质量m1 g,
实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别
为V1 mL、V2 mL。则通常状况时气体摩尔体积Vm=_____ L·moL-1。
四、(本题包括3小题,共30分)
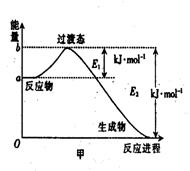
24.(8分)⑴20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理
论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的
过渡态。图甲是1mol白磷(P4)和足量O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)
和O2反应生成P4O10的热化学方程式:
(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
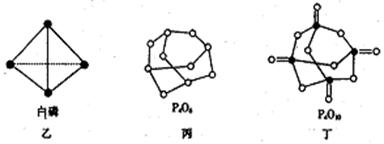
⑵白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间
插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个
氧原子(如图丁)。请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
⑶进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简
单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/ kJ·mol—1 | 198 | 360 | 498 | X |
已知白磷(P4)的燃烧热为2982kJ/mol,
白磷完全燃烧的产物结构如图丁所示,则上表
中x=_________。
⑷写出1 mol P4与O2反应生成固态P4O6的反应热△H=_____________。
25.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成
的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)
反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的
氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组
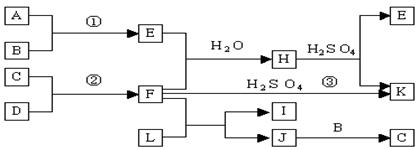 成,其相对分子质量为32。请按要求填空:
成,其相对分子质量为32。请按要求填空:
⑴反应③的化学方程式 。
⑵C的结构式 ;H的化学式 。
⑶L的溶液与化合物E反应的离子方程式 。
⑷化合物J的化学式 。
26.(12分)在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼
出1.0 kg的二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断的将座舱内的空气通过盛有金属过
氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式为:
① ,② ;
将处理后的气体充入座舱时,应注意采取的一项措施是 。
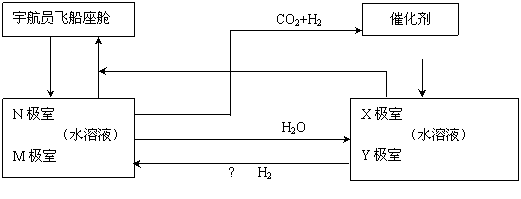 方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
① ② ③ CO2还原系统
O2
电化学二氧化碳处理系统 电解水系统
⑴管道①把飞船座舱内含有较多二氧化碳的潮湿的空气通入“电化学二氧化碳处理系统”的N
极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为 ,
其电解产物吸收二氧化碳的离子反应方程式为 。在N极吸收二氧化碳
后形成的离子会通过隔膜进入M极室,通过M极的电极反应可以使二氧化碳从电解液中释放出来,
并保持系统的pH不变;该电极反应式为 、 。
⑵管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航
员呼吸用。在“电解水系统”中Y为 极(填“阴”或“阳”)X极的电极反应为 。
⑶逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,
二氧化碳跟氢气在一定条件下反应,其产物中有甲烷等气体,请评价这种处理的意义
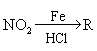 五、(本题包括2小题,共20分)
五、(本题包括2小题,共20分)
![]() 27.(10分)已知:①R—
—; ;②苯环上原有的取代基对新导入的取代基进
27.(10分)已知:①R—
—; ;②苯环上原有的取代基对新导入的取代基进
入苯环的位置有显著影响.当一取代苯进行取代反应时,新引进的取代基因受原取代基的影响而取
代邻、对位或间位。使新取代基进入它的邻、对位的取代基有-CH3、-NH2;使新取代基进入它的
间位的取代基有-COOH、-NO2;以下是用苯作原料制备一系列化合物的转化关系图:

⑴A转化为B的化学方程式是______________________________________________。
⑵图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②_______________________________。
⑶B在苯环上的一氯代物有 种同分异构体。
⑷有机物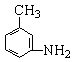 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
28.(10分)已知:HCN的结构为H —C≡N。
![]()
![]()
![]() R—CN RCOOH, R—Cl+CN— R—CN+Cl—(R为烃基)
R—CN RCOOH, R—Cl+CN— R—CN+Cl—(R为烃基)
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 , 它是重要的化工原料,它在一定条件下可发生以下变化:
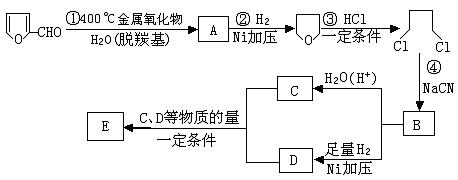
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式 。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
高三级模拟考试化学试卷参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | C | B | A | C | A | A | B | D | A | C | CD | CD | CD | BD | C | B | AC | AC |
21(10分,每空1分)⑴ ① 防暴沸; 冷凝; ② 防止环己烯挥发;
⑵ ① 上层; C; ② g; 冷却水与气体形成逆流; ③ 83oC; b; ⑶ C
22.(10分,最后一空2分,其余每空1分)⑴ 稀盐酸; KSCN溶液;
2Fe2++Cl2=2Fe3++2Cl-; Fe3++SCN-=[Fe(SCN)]2+
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色。
Fe3+的3d轨道填充了5个电子,为半充满状态
⑶ 不合理; 我的猜想是[Fe(SCN)]2+配离子中的SCN-被过量的氯水氧化。设计的实验为在
褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)。
23.(10分)⑴ ① CBEDG(2分); ②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强
变大(1分); ③待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,
再平视读取量筒中水的体积,即氢气在通常状况时的体积。(2分)
⑵ ① 使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴
![]() 下(1分);
滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差(1分)。
②
(3分)
下(1分);
滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差(1分)。
②
(3分)
24.(8分,每空2分)⑴P4(s)+5O2(g) === P4O10(s);△H=-(E2-E1)kJ·mol-1
|
25.(10分,每空2分) ⑴2NH3+H2SO4=(NH4)2SO4; ⑵N≡N,(NH4)2SO3或NH4HSO3;
⑶ClO-+SO2+2OH-=Cl-+SO42-+H2O(2分); ⑷N2H4(2分)
26.(12分)①2Na2O2+2CO2 === 2Na2CO3+O2;(2分)
②2Na2O2+2H2O === 4NaOH+O2↑(2分);充入适量水蒸气,增加“空气”湿度。(1分)
⑴O2+2H2O+4e— === 4OH—,2 OH—+CO2 === H2O+CO32—(各1分)
H2+2 OH——2e— ===2H2O,H2+CO32——2e—===H2O+CO2↑(各1分)
⑵阴; 4OH——4e- === 2H2O+O2↑(各1分)
⑶既能为电解系统提供水,又能减少太空污染,还能产生供飞船使用的燃料。(1分)
27.(10分,每空2分) ⑶4; ⑷不是
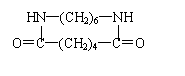 28.(10分,每式2分) ⑴加成反应 取代反应(各1分,共2分)
28.(10分,每式2分) ⑴加成反应 取代反应(各1分,共2分)
 ⑵
⑵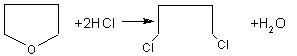

⑶
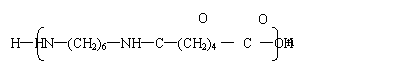 |
⑷