08届高考化学考前冲刺试题
第Ⅰ卷 选择题
1.下列化学用语表示错误的是 ( )
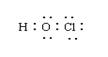 |
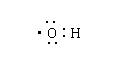
A.次氯酸电子式 B.羟基电子式
![]()
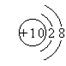
C.镁离子结构示意图 D.氨分子结构
2.巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3C00—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
3.参照反应Br + H2 → HBr +H的能量对反应历程的示 意图,下列叙述中正确的( )
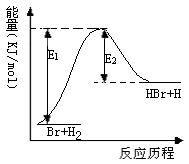 A. 正反应为吸热反应
A. 正反应为吸热反应
B. 正反应为放热反应
C. 加入催化剂,该化学反应的反应热降低
D. 加入催化剂可增大正反应速率,降低逆反应速率
4.军事上的“地表伪装’’是军事上保护的外观色彩、红外反射与环境吻合。BASF是新型红外伪装还原染料,为橄榄色或黑色。其化学结构如下:
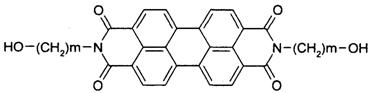
1mol该物质与钠在一定条件下反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为
A.1 mol,7 mol B.2 mol,10 mol C.1 mol,14 mol D.2 mol,14mol
5. 下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是 ( )
A.稀盐酸、 Na2CO3溶液 B.AlCl3溶液 、 NaOH溶液
C.NH4HSO4 溶液 、 Ba(OH)2溶液 D.浓氨水 、 AgNO3溶液
6. 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.足量的CO2与78g Na2O2发生反应,转移的电子数为2NA
B.100mL1mol/L FeCl3溶液中,阴、阳离子总数大于0.4NA
C.常温常压下,22.4 L H2中含质子数为2NA
D.18g的D2O与NA个CH3-具有相同的电子数
7、有关溶液中所含离子的检验,下列判断中正确的是
A、加入BaCl2溶液生成的白色沉淀不溶于稀硝酸,则原溶液中一定有SO42-存在
B、加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在
C、加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在
D、加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在
8、在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.物质B的质量分数增加了
D.a<b
第Ⅱ卷.非选择题
9.现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
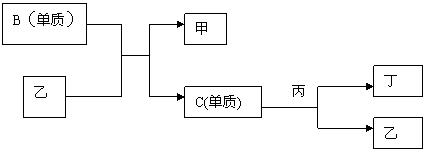 |
又知甲、乙、丙分子均含有10个质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是 — (填写选项的编号,下同)(①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 。
A.化合物甲与丙、乙与丙均能够发生反应
B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为 。
(3)按(2)中的另外三个补充条件推断第四种元素,丙的空间构型为___________。
10.我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
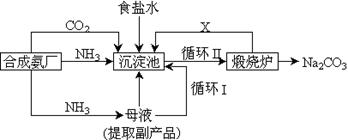
(1)沉淀池中发生反应的方程式为————————————————————————————————————————;
(2)该实验得到的纯碱中含有氯化钠,甲同学设计装置Ⅰ,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:
①——————————————————————————————————————————————————————————————————————————————
②——————————————————————————————————————————————————————————————————————————————
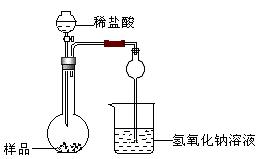
Ⅰ
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:

Ⅱ
①检查该装置气密性的方法为:————————————————————————————————————————————————————;
②设滴定管的其始读数为V1mL,终了读数为V2mL,注射器测定排除的气体为V3mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数的表达式为——————————————————(用含V1 、V2 、V3、m的代数式表示)
(4)丙同学设计的测定样品中纯碱含量的方法如图Ⅲ,并在广口瓶中的水上面滴加少量植物油,试回答:
①你认为植物油的作用是——————————————————
②为减小误差,读取量筒中水的体积时的注意事项有:
———————————————————,———————————————————————————————
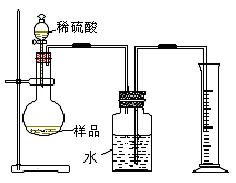
Ⅲ
11、 t℃时,将3molA和2molB气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB, 并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB, 并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C)都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充人__________(填A或B)________mol(用a表 示),达新平衡时,A的物质的量为n(A)___________(用含a的式子表示)。
12、已知在酸性条件下有以下反应关系:
(1)KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2
(2)Br2能将I-氧化为I2
(3)KIO3也能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2
①KBrO3、Br2、KIO3、I2氧化能力由强到弱的顺序为________________________________________。
②现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得的产物也不同。试将讨论的结果填入下表。
| 编号 | A的取值范围 | 产物的化学式(或离子符号) |
| A | I2、Br- | |
| B | 1/6<a<1/5 | |
| C | ||
| D | I2、IO3-、Br2 | |
| E |
③若产物中碘单质和碘酸钾的物质的量相等,a的值为__________________。
④当a的值为1时,其产物及物质的量分别为__________________________________。
参考答案:
1.C 1.D 2.A 4.C 5.B 6.B 7.C 8.B
9.(1)④2F2+2H2O=4HF+O2(2)B第二周期ⅣA族(3)三角锥型
10.(1)CO2+NH3+NaCl=NaHCO3↓+ NH4Cl
(2) ①稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收;
②烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收.
![]() (3) ①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后又回到原来位置,说明气密性良好.
(3) ①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后又回到原来位置,说明气密性良好.
②
(4) ①减少二氧化碳在水中的溶解,减小实验误差
②读数前将广口瓶与量筒之间导管中的水转入量筒;读取量筒中水的体积时要平视
11、⑴x=4 ⑵ > ⑶ C ⑷ B a/4 2.4+0.6a
12.①BrO3->IO3->Br2>I2
②
| 编号 | A的取值范围 | 产物的化学式(或离子符号) |
| A | 0<a≤1/6 | I2、Br- |
| B | 1/6<a<1/5 | I2、Br2、Br- |
| C | a=1/5 | I2、Br2 |
| D | 1/5<a<6/5 | I2、IO3-、Br2 |
| E | a≥6/5 | IO3-、Br2 |
③ 8/15 ④I2:0.1mol; IO3-:0.8 mol; Br2: 0.5mol