08届高考强化训练理综化学部分测试题
可能用到的相对原子质量:H—1、C—12、O—16
6.下列有关大气污染的说法中不正确的是( )
A.地球上的一切生命像离不开水和氧气一样离不开臭氧
B.造成温室效应的气体主要有CO2、O3、N2、CH4等
C.沙尘暴是大风扬起的沙尘使空气混浊、能见度恶化的一种大气灾害现象
 D.当雨水的pH低于5.6时称为酸雨
D.当雨水的pH低于5.6时称为酸雨
7.某烷烃分子中同时存在伯碳(—CH3)、仲碳(—CH2—)、叔碳( )、
![]()
季碳( )4种基团,最少应为含有几个碳原子的烷烃( )
A.6 B.7 C.8 D.9
8.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。请分析丙是( )
A.盐酸 B.碳酸钠 C.氯化钙 D.硝酸银
9.将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则这时溶液中应符合的关系是( )
| NaOH的质量分数 | 阳极析出的物质的质量/g | 阴极析出的物质的质量/g | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
10.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.IO3- B.H2O2 C.MnO4- D.HNO2
11.将aL NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中NH3的体积分数是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
12.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
13.分子式为C4H11N的物质共有几个同分异构体( )
A.8 B.7 C.6 D.9
26.(15分)A、B、C、D、E代表五种原子序数依次增大的元素。已知:
①A、B、C的电子层数之和为6;
②A、B能形成直线形四原子分子;
③C是短周期元素中质子数与最外层电子数之比值最大的元素;
④C、D、E同周期,D单质在适量E单质中燃烧生成两种化合物。
请回答下列问题:
⑴B元素的名称为 ,C元素的符号为 ,D元素的名称为 。
⑵上述五种元素中非金属性最强的是 (填元素符号),写出工业上制备这种元素的单质的离子方程式 。
⑶下述说法中,能说明五种元素中的某种元素具有最强的金属性的是 。
①最高价氧化物水化物的碱性最强
②最高价氧化物水化物的酸性最强
③形成的气态氢化物最稳定
④常温下与冷水反应能置换产生氢气
⑤所形成的化合物中只显正价
⑷五种元素构成的所有单质和化合物中,具有正四面体结构的分子共有 种,其中,一分子中含化学键数目最多的分子是 (填化学式)。
⑸D单质在足量E单质中燃烧的产物能遇水水解生成两种化合物,则该燃烧产物1mol与足量NaOH溶液反应最多能消耗 mol NaOH
| 阳离子 | K+ | Al3+ | Ba2+ | Mg2+ | Ag+ |
| 阴离子 | NO3- | Cl- | CO32- | SO42- | OH- |
27.(15分)仅由阴、阳两种离子组成的A、B、C、D、E均为可溶于水的固体,组成它们的十种离子为
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀和无色气体。
②C溶液与E溶液反应生成白色沉淀后,再加入D溶液又生成白色沉淀。
③B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
④E溶液与A、B、C、D溶液混合均能出现白色沉淀
据此推断它们是A________;B_________;C________;D_______;E_______。
28.(14分)在实验室中可以用下图所示装置制备某有机物并验证其性质.其中分液漏斗中装有溴乙烷,烧瓶a中装有乙醇和氢氧化钠固体。

⑴该实验要制备的有机物是 ,请用化学方程式表明该物质在工业生产中的一种用途 。
⑵安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象_______________.
⑶碎瓷片的作用是 ,装置e中NaOH溶液的作用是 。
⑷为探究烧瓶中反应后的液体中产物的存在形式,某生做了三个试管实验:
①干燥洁净的试管加无水硫酸铜再加适量的乙醇溶解,观察无现象。
②干燥洁净的试管加无水硫酸铜再加适量的烧瓶a中反应后的液体,观察有黑色沉淀生成。
③干燥洁净的试管加无水硫酸铜再加适量的乙醇溶解,再加一定量的NaOH固体,观察有蓝色沉淀生成。
根据上述三个试管实验分析,
本实验制备该物质的最合理的化学反应方程式为 ,
形成黑色沉淀的原因是 。
29.(16分)下图转化关系中A、B、C、D、E、F均为有机化合物,部分反应物和产物略去。已知C分子中所有的碳原子都在同一直线上。
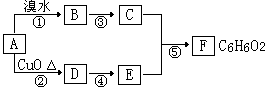
根据上图和中学化学所学有机化学知识回答下列问题:
(1)F作为烃的含氧衍生物,其类别是_____________。
(2)C和E的相对分子质量之差为_______________。
(3)如图中能发生加成反应的有机物是(填字母代号)_______________。
(4)请写出下列反应的化学方程式,并指出反应类型(有机物须用结构简式表示):
反应② 反应类型为 ;
反应③ 反应类型为 ;
反应⑤ 反应类型为 。
(5)F的同分异构体中能与FeCl3溶液发生显色反应数目有_______个。
写出其中与浓溴水发生取代反应时,消耗溴水能力最弱的同分异构体的结构简式________________。
6B7C8D9B10A11C12D13A
26
⑴碳,Na,磷(每空1分)⑵Cl(1分),2Cl-+2H2O=Cl2↑+H2↑+2OH-(电解)(2分)⑶①④⑤(3分)⑷3,P4 (每空2分)⑸8(2分)
27
A K2CO3;B Al2(SO4)3;C MgCl2;D Ba(OH)2;E AgNO3(每空3分)
28
⑴乙烯或CH2=CH2(1分),生成聚乙烯的方程式或乙烯水化的方程式(3分)⑵锥形瓶内液面下降,长玻璃管内的液面上升甚至溢出(2分)⑶防暴沸(1分),除去乙烯气体中混有的二氧化碳(2分)
![]()
⑷CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O(3分)
热的反应后的液体使氢氧化铜受热分解变成黑色的氧化铜(2分)。
29
⑴酯(1分)⑵16(1分)⑶A、C、D、E、F(2分)⑷HOCH2CH=CH2+CuO→Cu+OHCCH2CH=CH2+H2O(条件为加热)(2分),氧化(1分);
![]()
HOCH2CHBrCH2Br HOCH2C≡CH+2HBr(2分),消去(1分);
![]()
HOCH2C≡CH+ HOOCCH=CH2 CH2=CHCOOCH2C≡CH+H2O(2分),取代或酯化(1分)。
![]()
⑸3(1分), (2分)