08届高考理综化学模拟试题
可能用到的相对原子质量:
H∶1 C∶12 N∶14 O∶16 S∶32 Fe∶56 Cu∶64
6.在给定的四种溶液中,各离子能在该溶液中大量共存并形成无色溶液的是
A.滴加甲基橙试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B.pH=1的溶液:Cu2+、Na+、Mg2+、NO3-
C.由水电离出来的c(H+)=10-13mol/L的溶液中:K+、HCO3-、Br-、Ba2+
D.NaHSO4溶液中:K+、SO42-、NO3-、Al3+
7、2007年10月24日18时05分,搭载我国首颗探月卫星嫦娥一号的长征三号甲运载火箭在西昌卫星发射中心发射升空。肼(N2H4)是火箭发动机的燃料,它与N2O4反应时生成氮气和水蒸气。已知:N2(g) + 2O2(g)=== N2O4(g);△H= +8.7kJ/mol, N2H4(g)+ O2(g)=== N2(g)+ 2H2O(g);△H= -534.0 kJ/mol。下列肼跟N2O4反应的热化学方程式中,正确的是
A.2 N2H4 (g)+ N2O4(g)===3 N2(g)+ 4 H2O(g);△H= -542.7 kJ/mol
B.2 N2H4 (g)+ N2O4(g)===3 N2(g)+ 4 H2O(g);△H= -1059.3 kJ/mol
C.2 N2H4 (g)+ N2O4(g)===3 N2(g)+ 4 H2O(g);△H= -1076.7 kJ/mol
D.N2H4
(g)+![]()
![]() N2O4(g)===
N2O4(g)===![]() N2(g)+ 2H2O(g);△H= -1076.7 kJ/mol
N2(g)+ 2H2O(g);△H= -1076.7 kJ/mol
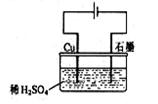 8.某同学按右图所示的装置进行电解实验。下列说法正确的是
8.某同学按右图所示的装置进行电解实验。下列说法正确的是
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
C.电解过程中,石墨电极上始终只析出H2
D.整个电解过程中,H+的浓度不断增大
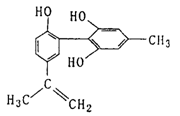 9.第29届奥运会将于2008年8月8日在北京开幕。我国提出“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
9.第29届奥运会将于2008年8月8日在北京开幕。我国提出“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4酸性溶液,观察紫色褪去,能证明结
构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗
Br2和H2分别为4mol、7mol
D.该物质能发生银镜反应
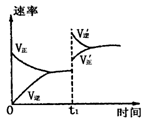 10.在密闭容器中进行反应2SO2(g)+O2 (g)
10.在密闭容器中进行反应2SO2(g)+O2 (g) ![]() 2SO3(g);△H<0;下图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<0;下图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
A.减小容器的体积,增大压强
B.增大生成物浓度或减小反应物浓度
C.升高体系的温度
D.使用催化剂
11.在金属焊接和切割现场,常能闻到一股鱼腥味。经检验,那是电弧产生的臭氧的气味。空气中含少量O3时,会使人产生振奋的感觉;当空气中O3的含量较高时,则对人体有害。臭氧具有很强的氧化性,可使湿润的碘化钾淀粉试纸变蓝。其反应的化学方程式为:
O3 + 2KI + H2O = 2KOH + I2 + O2。对此反应,下列说法正确的是
A.在此反应中O3是氧化剂,O2是还原产物
B.反应中有1molO3参加反应,转移电子为6mol
C.由此反应可知,氧化性强弱关系为:O3 > I2 > O2
D.被还原的氧原子与被氧化的I-的个数比为1∶2
12.设NA代表阿伏加德罗常数,下列说法正确的是
A.在常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,19.2g SO2中含有氧原子数为0.3NA
C.常温下,1L0.1mol·L-1的AlCl3溶液中所含Al3+的数目为0.1NA
D.1mol甲基(—CH3)中所含电子数为9NA
13.25℃时,物质的量浓度、体积都相同的NaA溶液(pH=8)和NaB溶液(pH=12),下列有关说法不正确的是
A.NaB溶液比NaA溶液更能促进水的电离
B.在NaA溶液中:c (Na+)-c (A-)=10-6mol/L
C.将两溶液混合,混合溶液中:c(OH-)>5×10-3mol/L
D.在NaB溶液中:c (H+)+c(HB)=10-2mol/L
26、(18分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出):
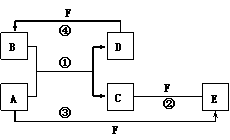
⑴若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的二倍,所含元素的原子的最外层电子数D是A的两倍,F的浓溶液与A、D反应都有红棕色气体生成,则:
B物质的分子式为:_________;
反应①的化学方程式为:_________________________________;
反应④的化学方程式为:_________________________________。
⑵若A是常见的金属单质,常温下D、F是气体单质,反应①在水溶液中进行,则:
物质A的化学式为:_____________;
F元素在周期表中的位置是:____________________;
写出B分子的电子式:_____________;
反应②(在水溶液中进行)的离子方程式是:___________________________。
⑶若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则:
反应①的化学方程式为:______________________________________;
B的固体属于__________晶体。
27、(12分)Cu—Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),现进行如下实验(以下气体体积均已折算成标准状况):
①将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为VmL,过滤得浅绿色溶液A(不含Cu2+)和滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO和NO2的混合气体896mL,经测定此混合气体的密度为1.52g/L。
③将①所得滤液加入到一定浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mLO2,气体恰好完全溶于水。
⑴、过滤时,应用到的玻璃仪器除烧杯和漏斗外,还需要____________________。
⑵、A中的金属阳离子是______________,滤渣B的成分是______________________。
⑶、被腐蚀前的合金中Fe的物质的量为_________mo1,Cu的物质的量为________mo1。
⑷、V的数值为__________。
28.(14分) 某课外小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
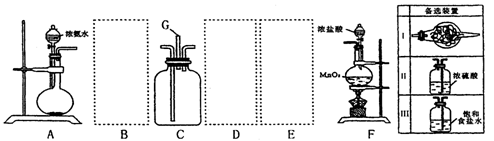
请回答下列问题:
⑴装置F中发生反应的离子方程式___________________________________________。
⑵装置A中烧瓶内的固体可以选用__________________________(选填以下选项的代号)
①.碱石灰 ②.生石灰 ③.二氧化硅 ④.五氧化二磷 ⑤.烧碱
⑶虚线内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格。
B________、D_________。
⑷氯气和氨气在常温下相混合就会反应生成氯化铵和氮气,该反应的化学方程式为____
________________________________。装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中阳离子为NH4+: ______________________________
___________________________________________________________________________。
⑸从装置C的G处逸出的尾气中含有少量Cl2,应如何处理才能不污染环境?
__________________________________________________________________________。
29.(16分)一种用于治疗高血脂的新药灭脂灵K,是按如图所示路线合成 (部分反应条件省略) 。
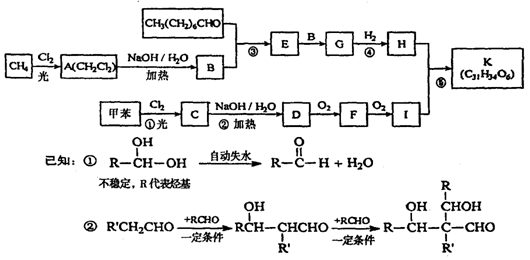
试回答下列问题:
⑴写出下列物质的结构简式:
C:________________________;K:__________________________________。
⑵能使FeCl3变紫色的D的同分异构体有____________种,请写出任意一种同分异构体的结构简式:__________________________。
⑶写出下列反应的化学方程式,并注明反应类型
反应②____________________________________________;反应类型为_______________。
F与新制的Cu(OH)2悬浊液反应
________________________________________________;反应类型为________________。
理综化学参考答案
6、D 7、C 8、B 9、C 10、B 11、D 12、D 13、B
26、(共18分,每空2分)
| |||
| |||
⑴CO2 2Mg + CO2 ===== 2MgO + C C + 4HNO3(浓) ==== CO2↑+ 4NO2↑+ 2H2O
|
|
2Fe2++Cl2
=== 2Fe3++2Cl![]()
|
⑶2C + SiO2 ===== Si + 2CO 原子
27、(共12分,每空2分)
⑴玻璃棒
⑵Fe2+ Cu
⑶0.04 0.05
⑷448
28、(共14分,每空2分)
|
⑴MnO2 + 4H+ + 2Cl- ==== Mn2+ +Cl2↑ + 2H2O
⑵①②⑤(少选或错选不给分)
⑶Ⅰ Ⅱ
⑷3Cl2 + 8NH3 ==== 6NH4Cl + N2 取固体少许于试管中,与强碱溶液共热,产生使湿润的红色石蕊变蓝色的气体,则含有NH4+。
⑸将尾气通入NaOH溶液中(或用碱液吸收尾气)
29、(共16分、每空2分)
⑴
⑵3 或 或
⑶ 水解反应或取代反应
氧化反应