08届高考化学一模试卷
相对原子质量:H—1 C—12 N—14 O—16 S—32 Fe—56 Cu—64
一、选择题(本题48分,包括8小题。每小题6分,每小题只有一个选项符合题意)
6. 在第36个“世界地球日”,我国国土资源部确定的主题为“善待地球—科学发展—构建和谐”。你认为下列行为中不符合这一主题的是
A. 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等石化燃料
B. 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
C. 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D .实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
7.设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
8.一定能在下列溶液中大量共存的离子组是 A.水电离产生的c(H+)=1×10-12mol·L-1溶液:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO![]()
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO![]() 、Al3+、SO
、Al3+、SO![]()
9.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,正确的是
A.钢铁腐蚀时可能发生的正极反应 4OH–
– 4e–![]() 2H2O
+ O2↑
2H2O
+ O2↑
B.表示中和热的离子方程式 H+
+ OH–![]() H2O; △H =
–57.3 kJ/mol
H2O; △H =
–57.3 kJ/mol
C.明矾水解反应的离子方程式 Al3+
+ 3H2O ![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
D.硫酸铵浓溶液与氢氧化钠浓溶液混合的离子方程式 NH4+ + OH–![]() NH3↑+
H2O
NH3↑+
H2O
10.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
| |
D.Y、Z两元素形成的化合物熔点较低
11. 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C
= 2AlN+3CO,下列叙述正确的是
A、在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B、上述反应中每生成2mol AlN,N2得到3mol电子
C、氮化铝中氮元素的化合价为-3价
D、氮化铝晶体属于分子晶体
12.一定温度下,在一容积固定的密闭容器中建立了如下平衡:2A(g)→ B(g),保持温度不变,若再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器A的体积分数比原平衡时
A 都减小 B 都增大 C 前者增大,后者减小 D 前者减小,后者增大
13.现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·L—1的硫酸溶液50mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为
A.1.6a g B.(a-1.6) g C.(a-3.2) g D.1.6 g
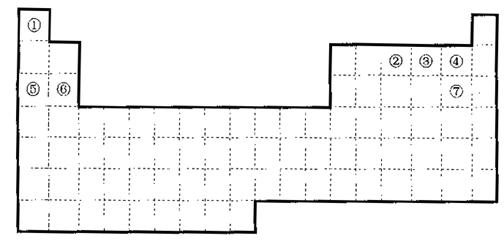
26.(共15分)下图是元素周期表的框架
|
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示)。
B.周期中表的元素④和元素⑦的氢化物的熔、沸点高低顺序是
(用化学式表示)。
C.①—⑦元素的某单质在常温下化学性质稳定,通常可以做保护气的是
(用化学式表示)。
D.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写离母a、b、c、d)。
a.IA族 b.ⅡA族 c.ⅣA族 d.VIIA族
|
;
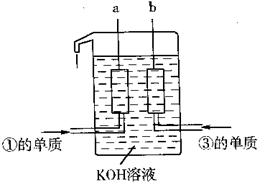
①、③两种元素的单质已被应用于
宇宙飞船的燃料电池中,如图所示,
两个电极均由多孔性碳构成,通入
的两种单质由孔隙逸出并在电极表
面放电。
请回答:b是电池的 极; a电极上的电极反应式是 。
27.(共14分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
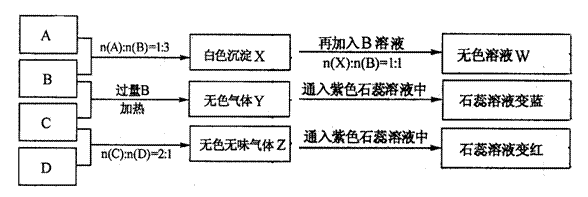
请回答:
(1)Y、Z的化学式分别为:Y ;Z 。
X与B反应的离子方程式为 。
(2)D溶液pH (填“大于”、“小于”或“等于”),原因是(用离子方程式表示)
。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式
。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
28、(共16分)(1)(8分)某校学生为探究乙二酸(俗称草酸)的部分化学性质,进行了下述实验:
I、 向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的高锰酸钾稀溶液,振荡,观察到的现象为___________________________________, 说明乙二酸具有__________ (填“氧化性”、“还原性”或“酸 性”)。
II、 课本实验设计得简要明了,但也存在一些不足,在探究过程中对其进行分析与改进也是研究性学习的一个重要课题。
已知草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃)产生CO和CO2,下图为高三课本中关于草酸晶体受热分解及验证其部分分解产物的实验装置图。
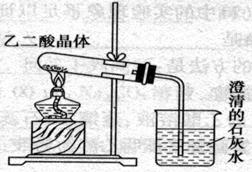
1)写出草酸晶体受热分解的化学方程式_____________________________________.
2)设计该装置欲验证的分解产物是_______________________ 。
3)草酸晶体的某些物理性质如下表:
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g.cm-3 | |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有的同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
① _______________________________________________________________________。
② _______________________________________________________________________。
(2)(8分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
①定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是
写出H2O2在二氧化锰作用下发生反应的化学方程式 。
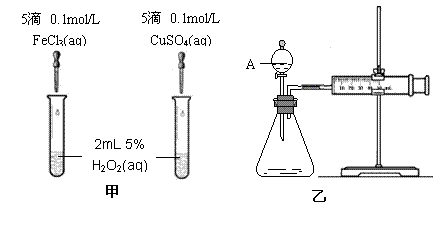 |
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
29.(共15分)实验测得A、B、C三种有机物的相对分子质量均为72。
(1)已知A中只含C、H 两种元素,且质量比为5:1,则其分子式为_____________, 它有_____ 种同分异构体,在它的同分异构体中,沸点最高的是___________ (写结构简式);一氯代物只有一种的是________________ (写名称)。
(2)已知B是烃的含氧衍生物,分子中只有一个官能团,且能发生银镜反应。请写出B可能的结构简式______________________________ 。
(3)C能发生如下变化
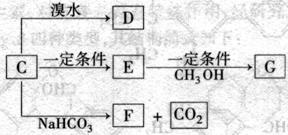
已知E和G都是高分子化合物,其中G是一种重要的有机合成材料。请按要求填空:
① C的结构简式为_______________________________ 。
② E→G的化学方程式为____________________________ 。此反应类型为___________。
理综化学参考答案
一、选择题(每题6分,共48分)
6.C 7.A 8.B 9.D 10.D 11.C 12.A 13.B
26.(共15分) (1)如图。(2分)
|
(2)A.NaOH > Mg(OH)2 ……………………………………………………(1分)
B.HF>HCl …………………………………………………………… (1分)
C.N2 …………………………………………………………………… (1分)
D.b; d …………………………………………………………………(2分)
(3)Al2O3 + 2OH- = 2AlO2- + H2O ……………………………………… (2分)
H2(g)
+ ![]() O2(g)
= H2O (l);△H =-2akJ/mol …………………………(2分)
O2(g)
= H2O (l);△H =-2akJ/mol …………………………(2分)
正(2分), 2H2+ 4OH--4e- = 4H2O
或H2 + 2OH--2e- = 2H2O ………………………………(2分)
27.(共14分)(1)NH3;CO2……………………………………………共2分
Al(OH)3+OH—=AlO![]() +2H2O…………………………………………………………2分
+2H2O…………………………………………………………2分
(2)大于;………………………………………………………………………………2分
![]() CO
CO![]() +H2O HCO
+H2O HCO![]() +OH—…………………………………………………………2分
+OH—…………………………………………………………2分
(3)NaOH>Na2CO3>AlCl3>NH4HSO4…………………………………………………2分
|
(5)Na+>SO![]() >NH
>NH![]() >H+=OH—…………………………………………………………2分
>H+=OH—…………………………………………………………2分
28、(共16分)
(1)(8分) I、溶液的紫红色褪去(2分) 还原性(1分)
II、1)H2C2O4﹒2H2O△→3H2O+CO↑+CO2↑(2分)
2) CO2(1分)
3) ① 草酸晶体在未达到分解温度之前,已融化成液体流出,使实验难以进行。(1分)
②该装置没有尾气处理,CO会污染空气。(1分)
其他合理答案也给分(如蒸出的草酸在石灰水中生成草酸钙沉淀等)
(2)(8分)
① 反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 (1分)
![]() 控制阴离子相同,排除阴离子的干扰(1分)2H2O2
2H2O+O2↑(2分)
控制阴离子相同,排除阴离子的干扰(1分)2H2O2
2H2O+O2↑(2分)
② 分液漏斗(1分)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;或固定注射器活塞,打开A处活塞,往分液漏斗中加水一段时间后液体不再流下证明该装置不漏气(2分), 时间(或收集一定体积的气体所需要的时间)(1分)
29.(共15分)(1)C5H12 (2分) 3 (1分) CH3CH2CH2CH2CH3(2分)
新戊烷或2,2-二甲基丙烷(1分)
(2)CH3CH2CH2CHO (CH3)2CHCHO (4分)
(3)①CH2=CHCOOH(2分)
②
![]()
![]()
![]()
![]()
![]() [CH2—CH ]n + nCH3OH 一定条件 [CH2—CH ]n + nH2O (2分)
[CH2—CH ]n + nCH3OH 一定条件 [CH2—CH ]n + nH2O (2分)
COOH COOCH3
![]()
![]() 酯化反应或取代反应(1分)
酯化反应或取代反应(1分)