08届高考化学复习原子结构巩固练习1
1.(2007年高考广东)铋(Bi)在医药方面有重要应用。下列关于![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
(A)![]() 和
和![]() 都含有83个中子 (B)
都含有83个中子 (B)![]() 和
和![]() 互为同位素
互为同位素
(C)![]() 和
和![]() 的核外电子数不同 (D)
的核外电子数不同 (D)![]() 和
和![]() 分别含有126和127个质子
分别含有126和127个质子
2.(2007年高考理综上海卷)放射性同位素14C可用来推算文物的“年龄”。14C的含量每减少一半要经过约5730年。某考古小组挖掘到一块动物骨骼,经测定14C还剩余1/8,推测该动物生存年代距今约为( )
(A)5730×3年 (B)5730×4年 (C)5730×6年 (D)5730×8年
3.(2007年高考理综宁夏卷)下列叙述错误的是( )
(A)13C和14C属于同一种元素,它们互为同位素 (B)1H和2H是不同的核素,它们的质子数相等
(C)14C和14N的质量数相等,它们的中子数不等 (D)6Li和7Li的电子数相等,中子数也相等
4.基态原子的4s能级中只有1个电子的元素共有( )
A.1种 B.2种 C.3种 D.8种
5.(2007年高考理综上海卷)地球上氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用上万年。下列说法正确的是( )
①3He、4He的化学性质基本相同 ②3He、4He具有相同的中子数
③3He核聚变是化学变化 ④3He液化是物理变化
(A)①② (B)①④ (C)②③ (D)③④
6.下列各组原子中,彼此化学性质一定相似的是:
A.x原子:1s2 y原子:1s22s2
B.x原子:M层上有两个电子 y原子:N层上有两个电子
C.x原子:2p亚层上有一个未成对电子 y原子:3p亚层上有一个未成对电子
D.x原子:L层上只有一个空轨道 y原子:M层上只有一个空轨道
7.(2007年理综北京卷)X、Y为短周期元素,X位于I A族,X与Y可形成化合物X2Y,下列说法正确的是( )
(A)X的原子半径一定大于Y的原子半径 (B)X与Y的简单离子不可能具有相同的电子层结构
(C)两元素形成的化合物中,原子个数比不可能为1:1
(D)X2Y可能是离子化合物,也可能是共价化合物
8.人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
9.科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,1s22s22p63s23p6。下列说法正确的
A.两粒子的1s能级上的电子能量相同 B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同D.两粒子都达8电子稳定结构,化学性质相同
10.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
(1)C原子的电子排布式为
(2)当n=2时,B的原子结构示意图为
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
(用元素符号表示)。
11.下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和
_____(填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4— 离子的空间构型为______________型。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写3种)
12.下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
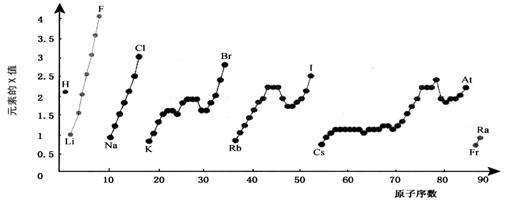
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是___________________________________________,同周期内,随着原子序数的增大,X值变化总趋势是______________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
10.Na的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成十2价离子。
5.(1)1s22s22p4
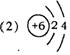
(3)第2周期I A族 O>P>Si>Li
11.(1)4s24p1
(2)d 0 N2 CN- C≡O
(3)CH4 CH3OH
(4)正四面体;可以为CO2、NCl3、CCl4、CO等电子式中的2个
12.(1)O,Mg;
(2)同一主族,从上到下,X值逐渐减小;逐渐增大;周期性;
(3)a;(4)bc