08届高考化学物质结构测试第三课时
1.下列实验方法不可用于区别晶体与非晶体的是 ( )
A.用肉眼观察外观是否光亮、透明,且有规则的几何外形B.通过实验看是否有较固定的熔点
C.对固体进行X-射线衍射实验 D.通过实验验证物理性质是否具有各向异性
2.下列说法正确的是( )
A、SiO2的空间构型为正四面体,且键角为60∘ B、H2SO4和CaO能真实表示物质分子组成
C、硅晶体、金刚石、二氧化硅晶体直接由原子构成的物质
D、CCl4和KCl化学键类型相同、晶体类型也相同
3.下列关于晶体的说法正确的是
A.离子晶体中一定不含共价键 B.SiO2晶体中每个Si原子与四个O原子以单键结合
C.金属晶体的熔点一定比原子晶体低、一定比分子晶体高 D.CsCl晶体中与Cs+的配位数位为6
4.二茂铁[(C5H5)2Fe]是一种有机过渡金属化合物。熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂。关于二茂铁的推断正确的是
A.二茂铁分子是极性分子 B.二茂铁晶体是分子晶体
C.二茂铁是共价化合物 D.二茂铁晶体中存在离子键
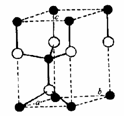 5.碳化硅具有高硬度、高耐磨性、高耐腐蚀性及较高的高温强度等特点,已成为一种重要的工程材料。其晶体具有六方ZnS型结构,右图是碳化硅的晶胞示意图,其中“○”表示Si原子,“●”表示C原子。下列有关说法中正确的是( )
5.碳化硅具有高硬度、高耐磨性、高耐腐蚀性及较高的高温强度等特点,已成为一种重要的工程材料。其晶体具有六方ZnS型结构,右图是碳化硅的晶胞示意图,其中“○”表示Si原子,“●”表示C原子。下列有关说法中正确的是( )
A.该碳化硅晶体的化学式可表示为Si5C9
B.平均每个晶胞中含有2个Si原子和2个C原子
C.在晶体中C原子填充在Si原子形成的四面体空隙中
D.该晶胞图能反映出SiC晶体的外形是立方体形
6.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C. [Cu(NH3)4] 2+的空间构型为正四面体型
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
7.下列各项的叙述中都包含两个数值,前一数值大于后一数值的是 ( )
A.单质碘中的分子间作用力和干冰中的分子间作用力
B.NaCl晶体中与一个Cl-紧邻的Na+数和CsCl晶体中与一个Cl-紧邻的Cs+数
C.晶体硅中Si—Si键的键能和金刚石中C—C键的键能
D.氨分子中N—H键的键角和甲烷分子中C—H键的键角
8.共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:
①Na2O2;②SiO2;③石墨;④金刚石;⑤CaH2;⑥白磷,其中含有两种结合力的组合是( )
A.①③⑤⑥ B.①③⑥ C.②④⑥ D.①②③⑥
9.美国诺尔斯、夏普雷斯及日本野依良治三位化学家在发现和合成手性催化剂方面有卓越贡献,被授予2001年诺贝尔化学奖。例如有机物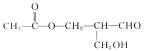 中有一个手性碳原子,它具有光学活性,它发生下列反应得到的有机产物中也具有光学活性的是(
)
中有一个手性碳原子,它具有光学活性,它发生下列反应得到的有机产物中也具有光学活性的是(
)
A.与乙酸发生酯化反应的产物 B.被铜网催化氧化后的产物
C.与银氨溶液作用后的产物 D.被H2还原后的产物
10.2005年9月始,“禽流感”在全球部分地区爆发,做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1mol物质得电子的数目表示)是 Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
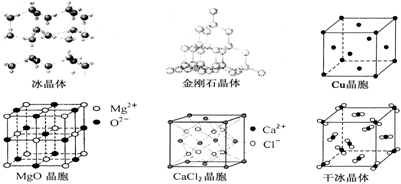 11.(12分)下图为几种晶体或晶胞的示意图:
11.(12分)下图为几种晶体或晶胞的示意图:
请回答下列问题:
⑴ 上述晶体中,粒子之间以共价键结合形成的晶体是 。
⑵ 冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为 。
⑶ NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能 (“大于”、“小于”)MgO晶体,原因是 。
⑷ 每个Cu晶胞中实际占有 Cu原子,CaCl2晶体中Ca2+的配位数为 。
⑸ 冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是
。
12.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
13.(4分)某配合物的化学式为 CoCl3·4NH3·H2O, 内界为正八面体构型配离子。1 mol该化合物溶于水中,加入过量 AgNO3,有2 mol AgCl生成。它的结构式是_______________,按无机化合物系统命名原则 ,命名为_________________________。
14.某固体仅由一种元素组成,其密度为5.0g∕cm¯3。用X射线研究该固体的结构时得知:在边长为10¯7cm的正方体中含有20个原子,则此元素的相对原子质量是多少?
14.(物质结构与性质,12分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ▲ ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ▲ ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ▲ ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ▲ ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ▲ ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ▲ ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。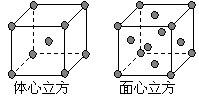 面心立方晶胞和体心立方晶胞中实际
面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为 ▲ 。
11.(第⑷小题每空1分,其余每空2分。本题共12分)
⑴ 金刚石晶体
⑵ 金刚石、MgO、CaCl2、冰、干冰
⑶ 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;
且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)
⑷ 4 8
⑸ H2O分子之间形成氢键
12.(1)[Al(OH)4] -
(2)Zn+2NaOH+2H2O=Na2Zn(OH)4+H2
(3)①③④
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制
13.[CoCl(NH3)4(H2O)]Cl2 二氯化一氯.四氨.一水合钴[Ⅲ]
14.∵ 1个该原子的质量:
M= p v
= 5.0g∕cm¯3(10¯7cm *)/20
=2.5*10—22
∴该元素的相对原子量为:
2.5*10—22*6.02*1023 = 150.5