高考化学复习电离平衡测试
一、选择题(共10小题,每小题3分,每小题只有一个答案符合题意)
1.常温下某溶液中由水电离的c(H+)=10—10mol·L—1,该溶液中溶质不可能是( )
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
2.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg![]() .下列叙述正确的是
( )
.下列叙述正确的是
( )
①任何温度下,水的AG等于0 ②溶液的AG越小,酸性越强
③常温下,0.1mol·![]() 盐酸的AG=12 ④25℃时,某溶液的AG=-10,其pH=10
盐酸的AG=12 ④25℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④ C.①② D.③④
![]() 4.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
4.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
5.健康人血液的pH总是维持在7.35~7.45之间,这是由于 ( )
A.人体内含有大量水分
B.血液中NaCl的含量保持恒定不变
C.人体排出的酸性物质与碱性物质部分溶解在血液中
D.血液中![]() 和
和![]() 只允许在一定的比例范围
只允许在一定的比例范围
6.用![]() 溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是
( )
溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是
( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
7.下列方法能使电离平衡![]()
![]()
![]() 向右移动,且使溶液呈酸性的
向右移动,且使溶液呈酸性的
A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体
D.将水加热到100℃,使水的pH=6
8.常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中 ( )
A.[![]() ]<[
]<[![]() ] B.[
] B.[![]() ]=[
]=[![]() ]
]
C.[![]() ]>[
]>[![]() ] D.无法确定[
] D.无法确定[![]() ]与[
]与[![]() ]的关系
]的关系
9.已知Cl2、Al2S3、CaC2、C2H5Br、CH3COOCH3等物质的均能与水发生反应,反应可视为各物质和水均分别离解成两部分,然后再两两重新组合,形成新的物质。下列化学反应符合这一特点的是 ( )
![]()
![]()
①ICl+H2O→HIO+HCl; ②CH3CCl+H2O→CH3 COH+HCl;
③CaC2+2H2O→Ca(OH)2+C2H2↑;④Mg3N2+6H2O→3Mg(OH)2+2NH3↑;
⑤SiCl4+4H2O→H4SiO4↓+4HCl↑。
A.只有①④⑤ B.只有②③⑤ C.只有①②③④ D.全部
10.如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是 ( )
|
| A | B | C |
|
| 0.12 | 0.04 | 0.03 | 0.09 | |
|
| 0.04 | 0.12 | 0.09 | 0.03 |
二、选择题(共10小题,每小题4分,每小题有1—2个答案符合题意)
|
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3
B.CH3COOH、NH3·H2O
C.NaOH、AlCl3
D.H2SO4、Ba(OH)2
12.常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为 ( )
A.11:1 B.10:1 C.6:1 D.5:1
13.正常人胃液的pH在0.3~1.2之间,酸(一般以盐酸表示)多了,需要治疗.某些用以治疗胃酸过多的药物中含![]() 、
、![]() ,还有用酒石酸钠来治疗.这主要是由于
,还有用酒石酸钠来治疗.这主要是由于
A.对人体而言酒石酸是营养品 B.![]() 、
、![]() 都是人体必需的元素
都是人体必需的元素
C.碳酸、酒石酸都不是强酸
D.![]() 、
、![]() 与胃酸作用生成
与胃酸作用生成![]() ,在服药后有喝汽水的舒服感
,在服药后有喝汽水的舒服感
14.将相同物质的量浓度的某弱酸HX与NaX溶液等体积混合,测得混合溶液中 C(Na+)>C(X-),则下列关系错误的是 ( )
A.C(OH-)<C(H+) B.C(HX)<C(x-)
C.C(HX)+C(x-)=2C(Na+) D.C(H+)+(Na+) C(X-)+C(OH-)
15.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是 ( )
A.![]() 的电离方程式:
的电离方程式:![]()
![]()
![]()
B.![]() 离子的水解方程式:
离子的水解方程式:![]()
![]()
![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
16.已知某溶液中存在![]() ,
,![]() ,
,![]() 和
和![]() 四种离子,其浓度大小有如下关系,其中可能的是
( )
四种离子,其浓度大小有如下关系,其中可能的是
( )
①![]() ②
②![]()
③![]() 且
且![]() ④
④![]()
⑤![]()
A.①④ B.③⑤ C.①②③ D.④⑤
17.下列各溶液中,微粒物质的量浓度关系正确的是 ( )
A.![]() 溶液中
溶液中 ![]()
B.![]() 溶液中:
溶液中: ![]()
C.![]() 溶液中:
溶液中: ![]()
D.![]() 溶液中:
溶液中: ![]()
18.常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,下述结论中正确的是
( )
的盐酸中,下述结论中正确的是
( )
A.若混合溶液的pH=7,则![]()
B.若![]() ,
,![]() ,则混合液中
,则混合液中![]()
C.若混合液的pH=7,则混合液中![]()
D.若![]() ,且混合液的pH<7,则一定有
,且混合液的pH<7,则一定有![]()
19.将![]() 硝酸铵溶液跟
硝酸铵溶液跟![]() 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
( )
A.![]()
B.![]()
C.![]()
D.![]()
20.将0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是 ( )
A.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
B.c(CH3COO-)>c(Cl-)>c(H+)> c(CH3COOH)
C.c(CH3 COO-)= c(Cl-)>c(H+)> c(CH3COOH)
D.c(Na+)+c(H+)= c(CH3COO-)+ c(Cl-)+c(OH-)
三、填空题
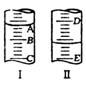 21.(10分)㈠图I表示10mL量筒中液面的位置,
21.(10分)㈠图I表示10mL量筒中液面的位置,
A与B,B与C刻度相差1mL,
如果刻度A为6,量筒中液体的体积是 mL。
㈡图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL C.一定大于a D.一定大于(50-a)mL
㈢用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA的溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分。)
(a)装HCl的试管中放出H2的速率快;
(b)装HA溶液的试管中入出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价乙方案中难以实现之处不妥善之处: 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
答:
。
22.(10分)工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拦,使之溶解,得一强酸性的混合溶液,现欲从该该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,理由是 现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有 (有几个选几个填代号)
A.浓HN3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A. NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
23.(12分)按要求回答下列问题:
(1)0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。
(3)只用一种试剂可能把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是 ,其中,MnO2与该试剂反应的化学方程式为 。
(4)实验室配制硝酸汞溶液时,须将其晶体溶于稀硝酸中,其原因是 ,所涉及反应的离子方程式为 。
(5)泡沫灭火剂包括![]() 溶液(约1mol/L)、
溶液(约1mol/L)、![]() 溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是____________________________.
溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是____________________________.![]() 溶液和
溶液和![]() 溶液的体积比约是____________.若用等体积、等浓度(mol/L)的
溶液的体积比约是____________.若用等体积、等浓度(mol/L)的![]() 代替
代替![]() 液,在使用时喷不出泡沫,这是因为__________________________.
液,在使用时喷不出泡沫,这是因为__________________________.
泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是___________________________________.
24.(6分)25℃时,若体积为Va=a、PH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb,a=0.5b,请填空白:
(1)a值可否等于3(填“可”或“否”) 理由是
(2)a的取值范围是:
25.(12分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①![]()
②![]()
③![]()
回答下列问题:
(1)相同条件下,HA、![]() 、
、![]() 三种酸中酸性最强的是_______________________.
三种酸中酸性最强的是_______________________.
(2)![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、HC2- 6种离子中,最易结合质子的是________,
、HC2- 6种离子中,最易结合质子的是________,
最难结合质子的是________.
(3)判断下列反应的离子方程式中正确的是(填写标号)__________________________.
A.![]()
B.![]()
C.![]()
(4)完成下列反应的离子方程式.
A.![]() (过量)__________________________;
(过量)__________________________;
B.HA(过量)![]() __________________________.
__________________________.
26.(8分)在0.5mol·L-1纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是;其原因是(用离子反应方程式和简要文字说明):
______________ ___________________________________________
_______________________________ _
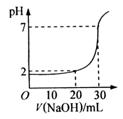
27.(11分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(6)根据上述各数据,计算烧碱的纯度; 。
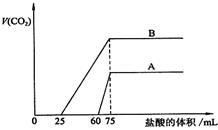
28.(16分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
|
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
答卷
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
21
22.
23.
24
25.
26.
27.
28.
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | A | C | D | D | B | B | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | C | C | AB | C | C | D | A | B | AD |
21.1、5.8 2、D
3、(1)100mL容量瓶(2)>;b(3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒难以达到表面积相同 (4)配制NaA溶液,测其pH>7,即可证明HA是弱电解质
22.(1)不能,因Fe2+沉淀的pH最大,F2+沉淀完全时,Cu2+也沉淀。①A②不妥当,引入了新杂质Na+ ③C、D、E(2)C、E、F
23.(1)2;2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
(2)Fe—2e-=Fe2+; 2H2O+O2+4e-=4OH-
(3)浓盐酸;MnO2+4HCl(浓)=MnCl2+Cl2+2H2O(加热)
(4)防止Hg2+水解生成沉淀;Hg2++2H2O=Hg(OH)2↓(或HgO)+2H+(加热)
(5).![]()
![]() 1∶6 由
1∶6 由![]() 转化为
转化为![]() 需
需![]() ,
,![]() 由
由![]() 提供(水解),现因
提供(水解),现因![]() 量不变,只能生成
量不变,只能生成![]() ,没有
,没有![]() ,喷不出泡沫,另外,
,喷不出泡沫,另外,![]() 表面生成
表面生成![]() 后,阻碍反应的进行
后,阻碍反应的进行![]() 水解产生的
水解产生的![]() 会腐蚀铁筒
会腐蚀铁筒
24(1)否 若a=3,则b=6显酸性 不合题意 (2)3.5<a<![]()
25.(1)![]() (2)
(2) ![]() ,
,![]() (3)BC(4)
(3)BC(4)![]()
![]()
26.现象: Ba2++CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O= HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1
27.(1)天平、小烧杯、药匙(2)小烧杯、玻璃棒、250mL容量瓶、胶头滴管 (3)碱式滴定管(或移液管) (4)左;酸;右;锥形瓶中溶液颜色的变化(5)0.4020mol·L-1 (6)98.05%
28.(1) NaOH、Na2CO3 3∶1 33.6 (2)Na2CO3、NaHCO3 1∶1 112
(3)
![]()
 D
D