高考化学第二次模拟考试试题
可能用到的相对原子质量:K—39 O—16 C—12 Fe—56 D—2 Na—23
第I卷(共50分)
一、选择题(每小题只有一个选项符合题意,2*10+3*10=50分)
1、最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2、下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.PCl5 C.HCl D.CF2Cl2
3、由两种原子组成的纯净物( )
A.一定是化合物 B.可能是单质,可能是化合物
C.一定是单质 D.一定是同素异形体
4、已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2 =2FeCl3 + 4 FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6 HCl=2CoCl2 + Cl2↑+3H2O D.2Fe3+ + 2I—=2Fe2+ + I2
5、将足量SO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入SO2体积(V)的关系正确的是 ( )
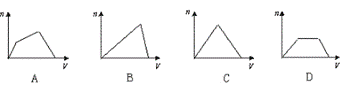
6、下列离子方程式中,书写不正确的是:( )
A. 常温下,Cl2与NaOH溶液反应: Cl2 + 2OH- Cl-+ ClO-+ H2O
B. 澄清石灰水与少量小苏打溶液混合:Ca2+
+ OH- + HCO3- CaCO3↓ + H2O
C. 稀H2SO4与Ba(OH)2溶液反应:Ba2++ OH—+H++SO42- BaSO4↓+ H2O D. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl-
7、我国神舟六号飞船发射时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ•mol-1。关于肼和二氧化氮反应的热化学方程式中正确的是( )
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ•mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ•mol-1
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g);△H=-1135.7kJ•mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=+1135.7kJ•mol-1
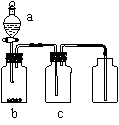
8、用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
| 气体 | a | b |
| |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | 浓硫酸 |
9、由钾和氧组成的某种离子晶体中,阳离子和阴离子的质量之比为13:8,其中阴离子只有过氧离子(![]() )和超氧离子(
)和超氧离子(![]() )两种。在此晶体中过氧离子与超氧离子的物质的量之比为( )
)两种。在此晶体中过氧离子与超氧离子的物质的量之比为( )
A.1:3 B.1:2 C.2:1 D.1:1
10、向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量是:( )
(1) 0.001mol (2) 0.002mol (3) 0.003mol (4) 0.004mol。
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
11、把一定质量的碳和8g氧气在密闭容器中高温反应,恢复到原来的温度,测得容器内压强比原来大0.4倍。则参加反应的碳的质量为:
A、2.4g B、4.2g C、6.0g D、无法确定
12、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是( )
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl D.可能有CO2、NH3和水蒸气
13、下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是( )
A Fe3+、CI-、Na+、SO42- B AI3+、Na+、CO32-、NO3-
C Ag+、Na+、SO42-、NO3- D AIO2-、CO32-、K+、Na+
14、经氯气消毒的自来水,若用于配置以下溶液:① NaOH ② AgNO3 ③Na2CO3 ④FeSO4 ⑤ KI ⑥ Na2S ⑦ Na2SO3,会使配置的溶液变质的是( )
A.全部 B.②④⑤⑥⑦ C.②⑤ D.④⑥
15、运用元素周期律分析下面的推断,其中错误的是( )
A.铍的氧化物的水化物可能有两性 B、硫酸锶是难溶于水的固体
C.砹为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀硝酸
D.硒化氢是无色、有毒、比H2S稳定的气体
16、![]() 、
、![]() 、
、![]() 的混合气体,与足量氧气混合完全燃烧后,生成的二氧化碳气体和水蒸气的体积比(同温同压下)为1:2,则原混合气体中
的混合气体,与足量氧气混合完全燃烧后,生成的二氧化碳气体和水蒸气的体积比(同温同压下)为1:2,则原混合气体中![]() 、
、![]() 、
、![]() 的体积比可能是( )
的体积比可能是( )
A.1:2:2 B.4:3:2 C.8:1:2 D.7:2:2
17、设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10NA
18、下列说法中正确的是 ( )
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
19、已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C3->D->B+>A2+ D.单质的还原性 B>A>D>C
20、将3.48g四氧化三铁完全溶解在100mL 1mol·L-1的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72—全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( ) ( )
A.0.05mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
二、填空题:(12分)
21、已知某饱和![]() 溶液的体积为V mL,密度为
溶液的体积为V mL,密度为![]() g/cm-3质量分数为W,物质的量浓度为Cmol/l,溶液中含
g/cm-3质量分数为W,物质的量浓度为Cmol/l,溶液中含![]() 的质量为m g,
的质量为m g,
(1)用m,V表示溶液物质的量浓度
(2)用W, ![]() 表示溶液物质的量浓度
表示溶液物质的量浓度
(3)用C, ![]() 表示溶液中溶质的质量分数
表示溶液中溶质的质量分数
(4)用W表示该温度下![]() 的溶解度
的溶解度
22、某种晶体的晶胞为立方体,结构如右图所示:通过观察和计算,回答下列有关问题:
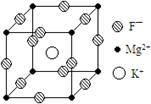 ①晶体中每个Mg2+周围与它最邻近的Mg2+围成的空间构型是
,每个F—周围与它最邻近的K+ 有 个。该晶体的化学式为
①晶体中每个Mg2+周围与它最邻近的Mg2+围成的空间构型是
,每个F—周围与它最邻近的K+ 有 个。该晶体的化学式为
②若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K置于晶胞的顶点,F—应占据立方体的
三、推断题:(15分)
23、中学化学中几种常见物质的转化关系如下:
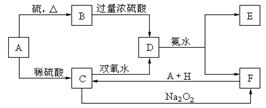
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。回答下列问题:
(1)红褐色胶体F粒子直径大小的范围: 。(2)A、B、H的化学式:A ,B ,H 。(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
四、实验题:(13分)
 24、下图所示为制取氯气的实验装置:烧瓶中盛放的固体是MnO2,请回答下列问题:
24、下图所示为制取氯气的实验装置:烧瓶中盛放的固体是MnO2,请回答下列问题:
(1)盛放药品前,怎样检验此装置的气密性_________________
(2)分液漏斗中盛放的液体是_ _,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为 (3)D中盛放的液体是_______;其作用为________
(4)B中盛放的液体是__________;收集氯气完毕,所进行的操作为______.B装置的作用是________.(5)欲收集到干燥纯净的氯气应对此装置进行一些改进.试画出改进的装置图,并标出装置中所盛放的药品:___
五、计算题:(10分)
25、现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084g。试回答:
(1)混合物中酸式碳酸盐的物质的量。
(2)加热灼烧后残留的固体含碳酸盐物质的量。
(3)通过计算确定两种盐的化学式,写出计算和推理过程。
 第二次模拟考试
第二次模拟考试
化学试题答题卡
| 一 | 二 | 三 | 四 | 五 | 总分 |
第I卷(共50分)
一、选择题(每小题只有一个选项符合题意,2*10+3*10=50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题:(12分)
21、(1) (2) (3) (4)
22、(1)
(2)
三、推断题:(15分)
23、(1) (2)
(3)① ②
(4) (5)
四、实验题:(13分)
24、(1)
(2)
(3)
(4)
(5)
五、计算题:(10分)
25、
第二次模拟考试
化学试题答案
第I卷(共50分)
一、选择题(每小题只有一个选项符合题意,2*10+3*10=50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | B | A | D | C | B | D | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | B | A | D | C | D | A | C | B |
二、填空题:(12分)
21、(1)200m/11.7V mol/L
(2)200![]() W/117 mol/L
W/117 mol/L
(3)117C/20![]() %
%
(4)100W/(1-W)g
22、(1)正八面体 4 KMgF3
(2)面心
三、推断题:
23、(1)1nm~100nm (2)Fe FeS H2SO4(稀)
(3)①H![]() H ②2Fe2++H2O2+2H+=2Fe3++2H2O
H ②2Fe2++H2O2+2H+=2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。(或其他合理答案)
(5)4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
四、实验题:(13分)
24、(1)将D装置中导管出口浸没在水面下,关闭分液漏斗活塞,打开K,加热A装置,D装置中有气泡冒出.关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气.
(2)
(3)氢氧化钠溶液;吸收多余的氯气.
(4)饱和食盐水;关闭活塞K,撤去酒精灯.贮存多余的氯气,防止氯气污染环境.
(5)应在B、C装置之间连接如图装置
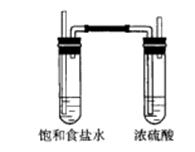
五、计算题:(10分)
25、(1)0.004mol
(2)0.003 mol
(3)Na2CO3和KHCO3
 c
c