基础练习
一、选择题(每小题有1~2个正确答案)
1、在抢救大出血的危症病人时,常需静脉点滴,输予0.9%的氯化钠溶液(俗称“生理盐水”)是由于人体血液的“矿化度”(即无机盐的相对含量)为0.9%。另有研究表明,30亿年前地表原始海水的矿化度即为0.9%。对此,下列猜测或评论中,不足取的是( )
A、人类祖先可能是从原始海洋中逐渐进化到陆地上的
B、人体血液和原始海水的矿化度均为0.9%纯属巧合
C、人体血液和原始海水之间存在着某些尚未被认识的关系
D、人体血液仍然带有原始海水的某些印痕
2、在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为( )
A、单质 B、分子 C、元素 D、氧化物
3、溴与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性强,下面是根据氯气的性质,对溴单质性质的预测,其中不正确的是 ( )
A、溴单质可以和烧碱溶液反应 B、溴单质只具有氧化性
C、溴原子最外层有7个电子,在化学反应中容易得1个电子
D、溴离子可以用硝酸酸化过的AgNO3溶液来检验
4、把碘从碘水里分离出来,有下列基本操作:①静置后分液 ②充分振荡 ③把碘水倒入分液
漏斗,再加入萃取剂四氯化碳。其正确的操作顺序是 ( )
A、①②③ B、③②① C、②③① D、③①②
5、在4份碘化钾淀粉溶液中,分别加入下列物质,能使溶液变蓝的是( )
A、氯化氢 B、溴水 C、氯气 D、溴化钠溶液
6、新制氯水与久置的氯水相比较,下列结论不正确的是( ) A
A、颜色相同 B、前者能使有色布条褪色
C、都含有H+ D、加AgNO3溶液都能生成白色沉淀
7、下列叙述中能证明次氯酸是一种弱酸的是( )
A、次氯酸不稳定,易分解 B、次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
C、次氯酸是一种强氧化剂 D、次氯酸能使染料和有机色质褪色
8、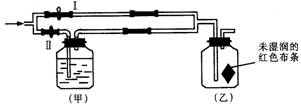 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶 ,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶 ,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
①浓H2SO4 ②NaOH溶液 ③KI溶液
④饱和NaCl溶液
A、② B、②③ C、①②③ D、①②④
9、用MnO2和浓盐酸制取氯气。当4mol氯化氢被氧化,生成的氯气的体积(标准状况)是( )
A、22.4L B、44.8L C、67.2L D、89.6L
10、KCl和KBr的混合物3.87克,溶于水并加入过量的AgNO3溶液后,产生6.63克沉淀,则混合物中含钾为 ( )
A、24.1% B、40.3% C、25.9% D、48.7%
二、综合题
11、洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为 。
⑵漂白粉的有效成分是(填化学式) 。漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
⑶瓶装漂白粉久置空气中会呈稀粥状而失效。分析为什么?
⑷请问:⑴中反应和⑵中反应,属于氧化还原反应的是(填编号) 。
12、已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
⑴写出元素X、Y、Z的元素符号:X: ,Y: ,Z 。
⑵写出A、B、C、D的化学式:A ,B ,C ,D 。
⑶写出③中反应的化学方程式 。
⑷写出④中反应的化学方程式 。
13、某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
第1步:灼烧。将足量海带灼烧成灰烬。该过程中使用到的玻璃仪器有 (填代号)
A、试管 B、瓷坩埚 C、坩埚钳 D、三角架 E、泥三角 F、酒精灯 G、容量瓶H、玻棒
第2步:Iˉ溶液的获取。操作是_________________________________________。
第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用_________(填代号)。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
理由是__________________________________________________________________。
第4步:碘单质的检验。取少量第3步的溶液,滴淀粉溶液,若溶液显蓝色,则证明含碘。
14、在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分。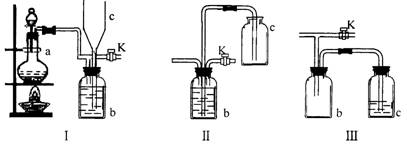
试回答:⑴若用[Ⅰ]制取氯气,b瓶中加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上升,你分析可能的原因是________________________,检查的简单方法是 。
⑵装置[Ⅰ]中b能防止多余气体逸散的原因____________________________ 。
⑶欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) ___________理由是______________________;
[Ⅲ]是否可行(填“是”或“否”) ____________理由是______________ 。
15、海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。试回答下列问题:
⑴海水中含有大量的氯化钠。氯化钠中的金属元素化合价为 。
⑵目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
⑶工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
![]() 食盐+H2O NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐
t 。
食盐+H2O NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐
t 。
|
|
|
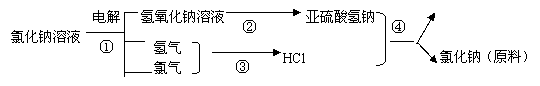
写出①③的化学反应方程式: ,
16、海水中溴常以NaBr形式存在,从海水中提取溴的方法之一是:①通入通入Cl2至浓缩的溴化物溶液,氧化海水中的Br-,然后用空气把生成的溴吹出。②以氢氧化钠溶液吸收Br2 (Br2跟烧碱生成NaBr和NaBrO3)。③向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。要求:⑴写出各步反应的化学方程式。(提示:第③步反应中生成物有硫酸钠)
⑵经分析海水中含溴0.0065%,则海水中含NaBr的质量百分含量为?试计算多少吨海水可制得1.0t溴?(假设提取过程中溴无损失)
第一单元 氯、溴、碘及其化合物
一、选择题(每小题有1~2个正确答案)
1、B 2、C 3、B 4、B 5、B C 6、A 7、B 8、C 9、B 10、B
二、综合题
11、⑴2Cl2 + 2 Ca(OH)2 == Ca (ClO)2 + CaCl2 + 2H2O
⑵Ca (ClO)2 Ca (ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO
⑶与空气中CO2及水蒸气反应,生成CaCO3和HClO;随后又有:2HClO=2HCl+O2↑;CaCO3+2HCl=CaCl2+CO2↑+H2O。 ⑷ ⑴
![]() 12、⑴Cl;O;K
⑵Cl2;KCl;KClO;KClO3
12、⑴Cl;O;K
⑵Cl2;KCl;KClO;KClO3
![]() ⑶ Cl2+2KOH=KCl+KClO+H2O ⑷2KClO3 = 2KCl+3O2↑
⑶ Cl2+2KOH=KCl+KClO+H2O ⑷2KClO3 = 2KCl+3O2↑
13、⑴ F H ⑵将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,煮沸,过滤
⑶D 过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染。
14、(1) 饱和食盐水;装置漏气;用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (2)关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。 (3) 是,原理与装置I同;否,由于c瓶密闭,体积不能改变,压强增大时有危险
|
|
⑷2NaCl+2H2O=== H2↑+Cl2↑+2NaOH, H2+Cl2====2HCl
16、⑴2NaBr+Cl2= 2NaCl+Br2;6NaOH+3Br2=5NaBr+NaBrO3+3H2O; 5NaBr+NaBrO3+3H2SO4= 3Na2SO4+3Br2+3H2O
⑵ 0.0084% 需海水的质量为15384.6 t