高考模拟试题理综化学卷
可能用到的相对原子质量: H—1、C—12、N—14、O—16、S—32、Cl—35.5、Cu—64
一、选择题(每小题只有一个正确选项,,每题6分;共48分)
1.下列说法正确的是
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.硫酸厂不应建在人口稠密的居民区和环保要求高的地区
D.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
2.用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
3.25℃时,在pH=13的溶液中可以大量共存的离子组是
(A)K+、Na+、![]() 、
、![]() (B)Na+、K+、
(B)Na+、K+、![]() 、Cl-
、Cl-
(C)H+、Mg2+、![]() 、
、![]() (D)Ag+、K+、
(D)Ag+、K+、![]() 、Na+
、Na+
4.卫生部下发紧急通知要求查处苏丹红“红心鸭蛋”。被查处的所谓“红心鸭蛋”是有人将工业染料“苏丹红4号”非法用作饲料添加剂,使得某些“红心鸭蛋”中含有对人体有害的苏丹红。“苏丹 红4号”的结构简式为: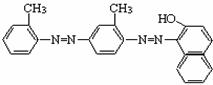
下列关于“苏丹红4号”说法中错误的是
(A)能发生加成反应 (B)分子式为C24H20N4O
(C)能被酸性高锰酸钾溶液氧化 (D)属于苯的同系物
5.二氧化硫的催化氧化是放热反应。下列关于接触法制硫酸的叙述中正确的是
(A)为防止催化剂中毒,炉气在进入接触室之前需要净化
(B)为提高SO2的转化率,接触室内反应温度选定在400℃~500℃
(C)为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收
(D)为提高SO3的吸收效率,用稀硫酸代替水吸收SO3
6.下列反应的离子方程式书写不正确的是
(A)硫酸铜水解:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
(B)澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2![]() =CaCO3↓+
=CaCO3↓+![]() +2H2O
+2H2O
(C)氯化铝溶液加入过量的氨水:Al3++3NH3·H2O=A1(OH)3↓+3![]()
(D)NaHSO4溶液中滴加NaHCO3溶液:H++![]() =H2O+CO2↑
=H2O+CO2↑
7.对于达到平衡的可逆反应:X + Y![]() W + Z,其他条件不变时,增大压强,正、逆反应速率(U)变化的情况如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是
W + Z,其他条件不变时,增大压强,正、逆反应速率(U)变化的情况如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是
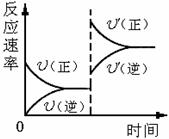
(A)W、Z均为气体,X、Y中只有一种为气体
(B)X、Y均为气体,W、Z中只有一种为气体
(C)X、Y或W、Z中均只有一种为气体
(D)X、Y均为气体,W、Z均为液体或固体
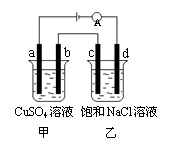 8.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
8.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
A.乙烧杯中d的电极反应为 2Cl––2e–![]() Cl2↑
Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
D.乙烧杯中发生的反应为
2NaCl + 2H2O
![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
二、(本题包括4小题,共60分)
9.(14分)几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +4、–2 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;
(3)A与J所形成化合物的晶体类型是 ,用电子式表示其形成过程 ;
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
10.(16分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
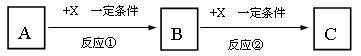
试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)_________________________________________,检验此C溶液中金属元素价态的操作方法是____________________________。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为_____________,X的化学式可能为(写出不同类物质)_________或_________,反应①的离子方程式为____________________________或____________________________。
11.(16分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
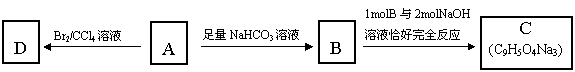 |
(1)咖啡酸中含氧官能团的名称为___________________________________________。
(2)咖啡酸可以发生的反应是____________________________________(填写序号)。
① 氧化反应 ② 加成反应 ③ 酯化反应 ④ 加聚反应 ⑤ 消去反应
(3)咖啡酸可看作1,3,4—三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为_______________________________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况)______________mL。
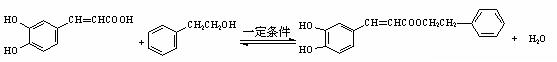
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为__________________________________________________。
|
化铜能否在在氯酸钾受分解实验中起催化作用。
实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,
向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,
加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示。
请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是(填写前面所述实验步骤的序号)
。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为 ×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述pH试纸测定溶液pH
的操作: 。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行
的实验操作是(按实验先后顺序填写字母序号) 。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的
实验中起催化作用。你认为还应该进行的另一个实验是
。
参考答案
一、选择题(每题6分;共48分)
1.C 2.D 3.B 4.D 5.A 6.B 7.B 8.D
二、(共60分)
9.(14分,每空2分)
(1)3 ⅥA
(2) F–、Na+、Al3+(若有“>”得分)
(3)离子晶体(只写“离子”不得分)
|
(4) Al2O3 + 2OH–![]() 2
2![]() + H2O 2Mg + CO2
+ H2O 2Mg + CO2 ![]() 2MgO + C
2MgO + C
10(16分,每空2分)
(1)d e (2分)
(2)FeCl3(2分)
2Fe3++Fe=3Fe2+ ,防止Fe2+被氧化(2分)
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈血红色,证明原溶液中有Fe2+存在。(答出要点可得分,其他正确答案参照本标准给分)(2分)
(3)Al(OH)3(2分)
NaOH(或KOH);HCl(或其他强酸)(2分)
Al3+ +3OH―=Al(OH)3↓(2分)
![]() +H++H2O=Al(OH)3↓(2分)
+H++H2O=Al(OH)3↓(2分)
(其他正确答案可参照本标准给分)
11.(16分)
(1)羧基(2分)、羟基(2分)
(2)①②③④(2分)
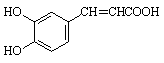 |
(3) (2分)
(4)448(4分)
(5)(4分)
12.(14分)
(1)①②③……………………3分 (2)![]() ……………………… 3分
……………………… 3分
(3)用干燥、洁净的玻璃棒蘸取少量溶液点在pH试纸上,并和标准比色板对比,读数…3分
(4)c a d b e………………………………3分
(5)另取相同质量的氯酸钾固体,不加CuO直接加热,对比放出氧气的反应速率…2分