高考化学规范训练二
Ⅰ卷(选择题共64分)
一、 选择题(每小题只有一个正确选项符合题意共24分)
1.将下列各组物质按酸、碱、盐分类顺序排列,正确的是
A.硫酸、纯碱、石膏 B.氢溴酸、烧碱、绿矾
C.石炭酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
2.下列化学用语书写正确的是
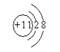 A.羟基的电子式:
A.羟基的电子式: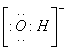 B.乙烯的结构简式:CH2CH2
B.乙烯的结构简式:CH2CH2
C.硝酸的酸酐分子式:NO2 D.钠离子的结构示意图:
3.下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO![]() )=0.1mol/L的溶液中:NH
)=0.1mol/L的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO![]()
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
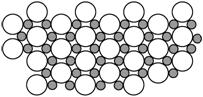 4.2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
4.2001年3月发现硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为( )
A.MgB B.MgB2 C.Mg2B D.MgB6
5、FeS2与HNO3反应的产物有Fe3+和H2SO4,若反应中FeS2和HNO3的物质的量之比是1∶8,则HNO3的还原产物是:
A.NO2 B.NO C.N2O D.N2O3
6.下列关于盐的反应规律的说法中不正确的是
①盐和酸反应一定生成另一种盐和另一种酸②盐和碱反应一定生成另一种盐和另一种碱③两种盐反应一定生成另外两种盐 ④阳离子相同的两种盐一定不能发生反应
A.只有② B.只有③ C.只有①④ D.①②③④
二、选择题(每小题有一到两个选项符合题意共40分)
7、下列离子方程式书写正确的是
A.向碳酸氢钠溶液中滴入少量氢氧化钠 HCO3-+OH-====CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水
2HCO3-+Ca2++2OH-====CO32-+2H2O+CaCO3↓
C.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O====HSO3-+HClO
D.硫酸铜和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-====Cu(OH)2↓+BaSO4↓
8.能说明碳元素的非金属性比硅元素强的是
A.甲烷比硅化氢稳定 B.碳与SiO2反应生成硅
C.碳酸与硅酸钠溶液反应生成原硅酸 D.高温下SiO2和Na2CO3反应
9.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42—、Cl—
B.在能使pH试纸变深蓝色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、NO3—、
D.在由水电离出的c(OH—)=10—13mol·L—1的溶液中:Na+、Ba2+、Cl—、I—
10.反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
下列有关说法正确的是
A.NaI 和NaIO3在一定条件下能反应生成I2
B.I2在反应⑴中是还原产物,在反应⑵中是氧化产物
C.两个反应中生成等量的I2时转移的电子数相等
D.氧化性:MnO2>IO3->I2>SO42->Mn2+
11,aXn-和bYm+是由短周期元素形成的简单离子,已知Xn-比Ym+多两个电子层,下列说法正确的是( )
A,X只能是第三周期元素
B,Y不可能是第二周期元素
C,b≤4
D,a-b+m+n等于10或20
12,某金属的最高价氧化物的相对分子质量为M,最高价氯化物的相对分子质量为N。若其最高正价为X,则用M、N来表示X的关系为 ( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
13.下列各选项中两种粒子所含电子数不相等的是
A.羟甲基(-CH2OH)和甲氧基(CH3O-)
B.硝基(-NO2)和二氧化氮(NO2)
C.亚硝酸(HNO2)和亚硝酸根(NO![]() )
)
D.羟基(-OH)和氢氧根(OH-)
14.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.099 | 0.102 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | -1、+7 | -2、+6 | -2 | -3,+5 | +2、+4 |
![]()
![]() 下列叙述正确的是
下列叙述正确的是
A.Z与X可形成ZX 、Z2X 等阴离子
B.R的氢化物的沸点高于X的氢化物的沸点
C.R的气态氢化物的稳定性强于W的气态氢化物
D.Z分别与X、R、W均可形成非极性分子的化合物
15.下列现象或应用不能用胶体知识解释的是
A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C.水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染
D.牛油与烧碱溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出
16.下列物质能通过化合反应直接制得的是
①FeCl2 ②Fe(OH) 3 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③
C.只有①③④ D.全部
Ⅱ卷(非选择题共86分)
三、(包括两小题共18分)
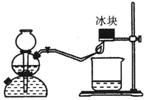 17.(6分)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如图所示的实验装置,验证该
17.(6分)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如图所示的实验装置,验证该
产物的存在。 实验步骤及现象如下:制H2、验纯,
将火焰对着冰块。
①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小
烧杯放在冰块下方,观察到烧杯中溶液由无色变成了蓝色。
②在另一个小烧杯内加入用硫酸酸化的稀KMn04溶液,将小烧杯放在冰块下方,观察
到烧杯中溶液变成了无色。
(1)另一产物的电子式为 ;
(2)由上述实验中可以归纳出该产物的化学性质有 。
(3)配平实验②中的反应方程式:
□ +□H++□MnO4-=□Mn2++□H2O+□O2↑
![]()
 18.(12分)某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO
18.(12分)某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO![]() 、SO
、SO![]() ,现取该溶液进行A、B、C三步实验,实验结果如下:
,现取该溶液进行A、B、C三步实验,实验结果如下:
(1)至实验A完成为止,分析题给信息:
①由“无色溶液”可以得出的结论: ;
②由有“气体甲”和“淡黄色沉淀甲”生成可以得出的结论:
;
③气体甲的成分有哪几种可能,答:a. b . c.
(有多少种就填多少种,可不填满。)
(2)沉淀乙是 (填化学式),由溶液甲生成沉淀乙的离子方程式为 。
(3)沉淀丙可能是 (填化学式)。
(4)综合上述信息,可以肯定存在的离子有 。
四(包括两小题共18分)
19.(8分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K3H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为______。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成V02+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9 g草酸,参加反应的钒元素质量是_______g。
20.(10分)6 mol的BrFm跟10 mol水恰好完全反应,可以得到氢氟酸以及等物质的量的溴酸、溴单质和氧气。试写出该反应的化学方程式 ;此反应的氧化剂是 ,还原剂是 。当有10mol水参加反应,被水还原的BrFm为 mol。
五(包括两小题共24分)
21.(12分) 下表是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“……”的四种元素外,其余元素都给出了该种元素的全部该类数据。
| (H) 13.6 | (He) 24.6 54.4 | ||||||
| (Li) 5.4 75.6 122.5 | (Be) 9.3 18.2 153.9 217.7 | (B) 8.3 25.2 37.9 259.4 340.2 | (C) 11.3 24.4 47.9 64.5 392.1 489.9 | (N) 14.5 29.6 47.4 72.5 97.9 552.1 …… | (O) 13.6 35.1 …… …… …… …… …… …… | (F) 17.4 34.9 …… …… …… …… …… …… …… | (Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据,回答下列问题:
(1)每组数据可能是该元素的________(填序号)
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是_______________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的________________族;
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)______Al(1)(填“大于”或“小于”)。
(3) 分析每个元素的一组数据:
①有些元素的一组数据中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_____________________________________________________的结论。
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第_____个
(每空2分,共12分 )
22.(12分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶1形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
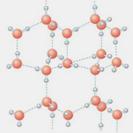 ⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,与每个“构成粒子”相邻的粒子呈 空间构型。E与D按原子个数比1∶1形成的化合物的电子式为 。
⑶人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C=D | D=D |
| 键能/kJ·mol—1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示): 。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c. F的单质
②试估算1mol F单质晶体完全燃烧放出的热量: 。
六,(包括一小题共8分)
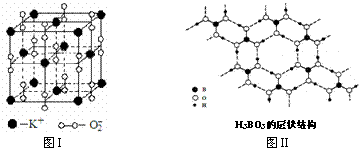 23.下图表示两种晶体的微观结构:
23.下图表示两种晶体的微观结构:
试回答下列有关问题:
⑴高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有 个,0价氧原子与-2价氧原子的数目比为 。
⑵正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有 。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中与每个“构成粒子”相邻的粒子呈平面正三角形空间构型。
)
七,(共两小题18分)
24.(6分)有一包由硝酸钾和不溶性杂质组成的固体混合物投入一定量的水中,在保证无水分蒸发的前提下,改变温度,测得固体混合物的溶解情况如下:
表一 实验结果
| 温度/℃ | 10 | 40 | 75 |
| 剩余固体/g | 261 | 175 | 82 |
表二 硝酸钾在不同温度时的溶解度
| 温度/℃ | 10 | 40 | 50 | 60 | 65 | 80 |
| 溶解度/g | 20.9 | 63.9 | 85.5 | 110 | 126 | 169 |
| 温度/℃ | 10 | 40 | 50 | 60 | 65 | 80 |
| 溶解度/g | 20.9 | 63.9 | 85.5 | 110 | 126 | 169 |
| 温度/℃ | 10 | 40 | 50 | 60 | 65 | 80 |
| 溶解度/ g | 20.9 | 63.9 | 85.5 | 110 | 126 | 169 |
通过计算回答:
(1)实验过程中所用水的质量是________。
(2)对75℃时所得溶液的下列说法中正确的是
A.该溶液是饱和溶液 B.该溶液是不饱和溶液
C.82g剩余固体中一定含有硝酸钾 D.82g剩余固体中可能含有硝酸钾
(3)原固体混合物中含硝酸钾的质量。
25.(12分)已知Fex O晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,x值小于1。测知Fex O晶体密度ρ为5.71 g·cm-3,晶胞边长为:
4.28×10-10m。求
(1)FexO中x值(精确至0.01)为多少?
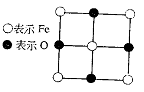 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(3)在完整晶体中,与O2-等距且最近的6个Fe占据空隙是何种几何形状?
(4)在晶体中,铁元素的离子间最短距离为多少米
参考答案
![]() 17.(每小题2分,共6分)
(1)
(2)氧化性、还原性
17.(每小题2分,共6分)
(1)
(2)氧化性、还原性
(3)5H2O2 、6、2、2、8、5
18.(12分)(1)①溶液中无Fe3+ ②溶液中含有S2-、SO![]() ,不含有Ag+ 、Ba2+和Al3+
,不含有Ag+ 、Ba2+和Al3+
③ H2S SO2(2)Al(OH)3 Al3++3HCO![]()
Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3和BaSO4 (4)S2- SO![]() AlO
AlO![]() Na+
Na+
19.⑴K2O·V2O5·2UO3·3H2O(2分)(不必考虑物质的排列顺序)
⑵1、1、1、2、1(2分) H2C2O4(2分) 0.51(2分)
21.(1)C (2)①增大 ②ⅡA 和ⅤA ③大于
(3) ①原子核外电子分能层排布 ②7
22. ⑴NaHCO3 CH3COONa(或其他有机酸的盐)
⑵氢键 正四面体 ![]()
⑶①acb ②990.7
23.(8分)12(1分) 3:1(3分) ③、④、⑥(4分)
24.(1)200g (2分)
(2)B (3分)
(3)220.8g (3分)