高考化学课本实验的整合与拓展练习(1)
――气体实验室制法
【学习目标】
1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)
2.能绘制和识别典型的实验仪器装置图
3.根据实验现象,观察、记录、分析或处理数据,得出正确结论
【典型例题】
【例1】 下列 5 个有 SO2 气体产生反应中:
![]() ①S + O2
SO2 ②Na2SO3
+ H2SO4 = Na2SO4 + SO2↑+ H2O
①S + O2
SO2 ②Na2SO3
+ H2SO4 = Na2SO4 + SO2↑+ H2O
③Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
![]()
④C + 2H2SO4(浓) CO2↑ + 2SO2↑+ 2H2O
⑤4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
(1)适宜于作实验室制取 SO2 气体的反应有 (反应式前的序号,下同)。
(2)现有一套实验室用 MnO2 和 HCl(浓)反应制取 Cl2 的装置,若采用该装置制取 SO2 气体,则应选择的反应原理是 。
【例2】下列装置都可用作实验室发生氨气的装置:
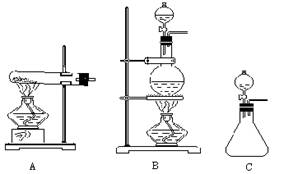 若选用A装置,则制取氨气的化学方程式是
;若选用B装置,则制取氨气的化学方程式是
;若选用C装置,则可选用浓氨水和 (选填:①NaOH溶液 ②NaOH固体 ③CaO固体 ④NH4Cl溶液),其制取原理是(可以写反应方程式)
。
若选用A装置,则制取氨气的化学方程式是
;若选用B装置,则制取氨气的化学方程式是
;若选用C装置,则可选用浓氨水和 (选填:①NaOH溶液 ②NaOH固体 ③CaO固体 ④NH4Cl溶液),其制取原理是(可以写反应方程式)
。
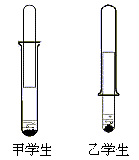 【例3】 有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。
【例3】 有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。
(1)哪个学生设计的装置比较合理? ,用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是 。
(2)实验室还可用 代替稀硫酸与铝反应制取氢气,其反应的离子方程式为 (必须与上述反应原理不相同)。
【例4】 如图装置,当浓盐酸与重铬酸钾[K2Cr2O7(s)]共热时产生气体单质X,经过A、B两瓶,在C处X与热的白色晶体反应,最后在D瓶内壁有紫黑色晶状物,请回答:
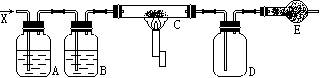
⑴制取气体X时,需要用到的玻璃仪器有 。
⑵要得到纯净的气体X,A瓶盛有 ,其作用是 ;B瓶盛有 ,其作用是 。
⑶若C处白色晶体其焰色为紫色,则C的电子式为 ,D瓶内壁的晶状物是 ,可用 来洗涤。
⑷在C处加热的目的是 。
⑸E装置中盛有碱石灰,其作用是 。
⑹该装置存在缺点为 。
【课堂练习】
1.实验室利用Zn和稀HCl反应制取H2,下列措施中,不能提高化学反应速率的是( )
A.增大盐酸的浓度 B.给反应液加热
C.向溶液中加入少量硫酸铜溶液 D.向溶液中加入醋酸钠晶体
2.按下列实验方法制备气体,合理又实用的是( )
A.锌粒与稀硝酸反应制备氢气 B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2 D.大理石与浓硫酸反应制备CO2
3.下列盛放试剂的方法正确的是 ( )
A.浓硝酸存放在带橡皮塞的棕色玻璃瓶中
B.汽油或煤油存放在带橡皮塞的棕色玻璃瓶中
C.氢氧化钾溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
4.用pH试纸测定某无色溶液的pH值时,规范的操作是 ( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
5.能证明乙酸是弱酸的实验事实是 ( )
A.乙酸能与碳酸钠溶液反应放出二氧化碳 B.乙酸和锌反应,速率比同浓度的盐酸慢
C.乙酸钠溶液的pH大于7 D.乙酸能使石蕊试液变红色
6.回答下面问题:
(1)在进行沉淀反应的实验时,如何认定沉淀已经完全?
答: 。
(2)中学化学实验中,在过滤器上洗涤沉淀的操作是
。
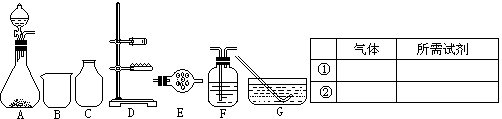
7.某化学课外小组欲用固体与液体反应(不需加热),快速简便制取一满瓶(125mL)干燥的氧气。
(1)从A~G中所提供的仪器(或装置),选出所需要的(填序号) ;除导管及胶管外,还需要的仪器用品有 。选用的试剂为 。
(2)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请写出还可用此装置制取的两种其它气体与制取该气体所需的试剂。
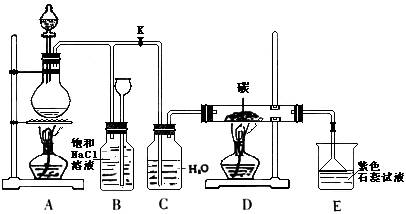 8.下图是实验室制 取Cl2 并以Cl2
为原料进行特定反应的实验:
8.下图是实验室制 取Cl2 并以Cl2
为原料进行特定反应的实验:
(1)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。 通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,生成CO2和HCl(气),试写出D装置中反应的化学方程式___________ _ ______;装置C的作用是______________________________。
(2)E处石蕊试液的现象是____________________,其原因是_______________ 。
(3)若将E处溶液改为石灰水,反应过程的现象是___________________
A. 有白色沉淀生成 B. 无白色沉淀生成 C. 先生成白色沉淀,然后沉淀消失
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2 产生,此时B中的现象是__________________,B的作用是 。
【课后练习】
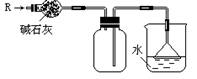
1.实验室可用下图所示的装置干燥、收集某气体R,并吸收多余的R,则R是( )
A.CH4 B.HCl C.Cl2 D.NH3
2.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
A.浓H2SO4;无水CaCl2固体 B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2CO3溶液;稀H2SO4
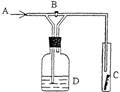 3.右图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
( )
3.右图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
( )
A.浓H2SO4 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
4.实验室提供以下常用仪器,供完成下列气体制取实验时选用(不可重复选用)。
 |
① ② ③ ④ ⑤ ⑥
(1)实验室采用加热高锰酸钾晶体制取O2时,其发生装置必需选用上述仪器中的(填写序号,下同) ,还缺少的仪器是 。
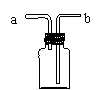 (2)过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,它在土豆块的催化作用下能迅速分解,放出氧气。若实验室采用该反应原理制取O2,并且在实验过程中可以随时添加双氧水,上述仪器中必需使用的有
。
(2)过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,它在土豆块的催化作用下能迅速分解,放出氧气。若实验室采用该反应原理制取O2,并且在实验过程中可以随时添加双氧水,上述仪器中必需使用的有
。
(3)若直接使用右图所示装置收集O2,O2由 口进入;若将装置中充满水,O2由 口进入。该装置除收集气体外,还可用作 。
5.草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取W g草酸晶体,配成100.0 mL溶液。
(2)取25.0 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①实验(1)中,为配制准确的草酸溶液,必须使用的仪器有__________________ __________________________________________;
②实验(2)中,滴定时,KMnO4溶液应盛在___________中(填酸式或碱式滴定管);
③若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低、无影响);
④滴定终点时,锥形瓶内溶液颜色变化是__________________________________;
⑤若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值。
6.用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
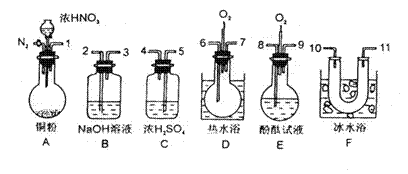 |
已知:①NO+NO2+2OH-→2NO
试回答:(1)仪器的连接顺序(按左→右连接,填各接口的编号)为 。
(2)反应前先通入N2目的是 。
(3)确认气体中含NO的现象是 。
(4)装置F的作用是 。
(5)如果O2过量,则装置B中发生反应的化学方程式为:
。
专题( )课本实验的整合与拓展(1)答案:
例题例1答案 (1)②③ (2)③
例2答案 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
NH3·H2O
CaCl2+2NH3↑+2H2O
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
![]()
![]() ②(或③) 浓氨水中存在下列平衡:NH3+H2O NH3·H2O NH4++OH—,加入NaOH固体,上述平衡逆向移动(或CaO+NH3·H2O= NH3↑+Ca(OH)2)
②(或③) 浓氨水中存在下列平衡:NH3+H2O NH3·H2O NH4++OH—,加入NaOH固体,上述平衡逆向移动(或CaO+NH3·H2O= NH3↑+Ca(OH)2)
例3答案(1)乙 将小试管伸入的试管底部,待小试管中充满气体后,再慢慢将大试管提起(2)NaOH溶液 2Al+2OH—+2H2O=2AlO2—+3H2↑
例4答案 ⑴分液漏斗、烧瓶、导管、酒精灯
⑵饱和食盐水 吸收Cl2中混有的HCl 浓H2SO4 吸收Cl2中混有的H2O
⑶![]() I2 酒精等
⑷使生成的I2升华,与其他固体分离
I2 酒精等
⑷使生成的I2升华,与其他固体分离
⑸吸收多余的Cl2,防止污染空气 ⑹连接C、D的导管易被I2堵塞
点评 本实验的目的是制取I2。
课堂练习
| 1D | 2C | 3D | 4C | 5C |
6.(1)在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀已经完全
(2)向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次
7. (1)AEC或AFC 火柴、玻璃片 Na2O2、水(或MnO2、H2O2)、碱石灰或浓硫酸
(2) ①NH3 浓氨水、生石灰 ②C2H2 电石、水或饱和食盐水或其它合理答案
8. (1) 2Cl2+C+2H2O![]() 4HCl +CO2 提供D处所需的水蒸气 (2)石蕊试液先变红色,后变无色 生成的HCl使石蕊试液变红。未反应完的Cl2
与H2O作用产生HClO,HClO的漂白作用使红色消失 (3)B (4)瓶中液面下降,长颈漏斗内液面上升 瓶中的气体呈黄绿色 贮存少量 Cl2,避免Cl2 对环境的污染
4HCl +CO2 提供D处所需的水蒸气 (2)石蕊试液先变红色,后变无色 生成的HCl使石蕊试液变红。未反应完的Cl2
与H2O作用产生HClO,HClO的漂白作用使红色消失 (3)B (4)瓶中液面下降,长颈漏斗内液面上升 瓶中的气体呈黄绿色 贮存少量 Cl2,避免Cl2 对环境的污染
课后练习
| 1D | 2B | 3B |
4.(1)①③④ 带导管的单孔橡皮塞 (2)②⑥(3)b a 干燥装置(或洗气装置
5.⑴容量瓶、烧杯、玻棒、胶头滴管、托盘天平 ⑵酸式滴定管 ⑶偏低 ⑷溶液颜色变为紫色 ⑸0.1aV (50W/9aV)-5
6.(1)1 5 4 10 11 6 7 2 (10和11可颠倒) (2)驱赶装置中空气,防止反应产生的NO被氧化 (3)通入O2后装置(D)中有红棕色气体生成 (4)分离NO和NO2(或使NO2液化或其他合理答案) (5)4NO2+O2+4NaOH→4NaNO3+2H2O