高考化学教学调研测试题
命题:谭素明 姚建军 审核: 周炳兴
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共120分。考试时间100
分钟
2.请将第Ⅰ卷和第Ⅱ卷的答案填写在答题卷的指定栏目内。
可能用到的相对原子质量:H-1 O-16 N-14 S-32 K-39 Ca-40 Fe-56
第Ⅰ卷 选择题 (共48分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列关于环境问题的说法正确的是 ( B )
A.pH小于7.0的降雨通常称为酸雨
B.在燃煤中加入适量石灰石,可减少煤燃烧时对空气的污染
C.含磷合成洗涤剂易于被细菌分解,故不会导致水体富营养化
D.水厂常同时加入硫酸亚铁和氯气处理水,能消毒杀菌但不能除去水中悬浮杂质
2.下列说法正确的是: ( C )
A.16O2与18O2互为同位素,H2O、D2O、T2O互为同素异形体,N60和N2互为同系物。
B.同主族元素的氢化物沸点均随着相对分子质量增大而升高
![]() C.在CsCl晶体中,每个Cs+周围与其最近等距离的Cs+为6个。
C.在CsCl晶体中,每个Cs+周围与其最近等距离的Cs+为6个。
![]() D.Ca2+的结构示意图为
, NH4Cl的电子式为
D.Ca2+的结构示意图为
, NH4Cl的电子式为
3.下列叙述正确的是 ( D )
A.二氧化硅是人类将太阳能转换为电能的常用材料
B.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内用水吸收制成浓硫酸
C.为检验酸性溶液中的Cl-和SO42-,先加BaCl2溶液,滤去沉淀后再加AgNO3溶液
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
4.以氮化硅(Si3N4)和氧化铝(Al2O3)为原料,采用常压烧结或热压工艺制备赛伦(Sialan)。赛伦的化学通式为Si6-xAlxOxN8-x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用。它属于 ( A )
A.新型无机非金属材料 B.金属材料
C.有机高分子材料 D.无机高分子材料
5.目前人类已发现的非金属元素除稀有气体外,共有16种。下列对这16种非金属元素的相
关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③
氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成对应的酸 ( D )
A.只有②③正确 B.只有①③正确
C.只有④正确 D.①②③④均不正确
6.关于下列各装置图的叙述中,不正确的是 ( A )
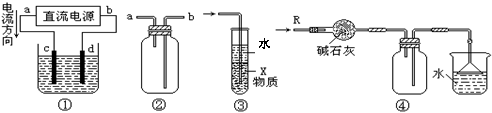 |
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
7.通过复习总结,你认为下列对化学知识概括合理的组合是 ( C )
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子品体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④在熔化状态和水溶液中均不能导电的物质称为非电解质
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥过氧化氢和液氮的分子中都有非极性共价键
A.只有①②⑥ B.只有③④ C.只有③⑥ D.只有⑤⑥
8.下列说法中,不正确的是 ( C )
A.在NaAlO2溶液中,HSO3-(H2SO3的电离常数K1=1.5×10-2;K2=1.0×10-7)不能大量存在
B.在0.1mol·L-1的CH3COOH溶液中加入适量的蒸馏水,溶液中的c(OH—)增大
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+一定不能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。
9.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 ( AC )
A.32g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023
B.200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子数的总和是6.02×1023
C.5.6g铁粉完全溶于硝酸,失去的电子数介于0.2×6.02×1023∽0.3×6.02×1023之间。
D.在SiO2晶体中,若含有1mol Si原子,则含Si—O键数为2×6.02×1023
10.向5mLNaCl溶液里滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为 ( C )
A.KSP(AgCl)= KSP (AgI)= KSP (Ag2S) B.KSP (AgCl)<KSP (AgI)<KSP (Ag2S)
C.KSP (AgCl)>KSP (AgI)>KSP (Ag2S) D.因发生特殊反应,无法判断
11.能正确表示下列反应离子方程式的是 ( D )
A.过氧化钠固体与水反应:2O22—+2H2O == 4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O=Cl—+SO42-+2H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
|
|
A.放电时储氢合金作正极
B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大
D.充电时储氢合金作阴极
13.根据下列有关图象,判断下列说法不正确的是 (A B )

|
A.由图象Ⅰ可知,该反应在T1、T3处达到平衡,且该反应的△H<0
B.由图象Ⅱ可知,该反应在t5阶段NH3体积分数最大
C.图象Ⅲ是在10L容器中850℃时反应,由图可知到4min时,反应放出51.6kJ的热量
D.由图象Ⅳ可知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
14.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是 ( A )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
第Ⅱ卷 非选择题(共72分)
三、本题包括1小题,共12分。
15.(12分)已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2 滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
1、仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳 、硫氰化钾溶液 、硝酸银溶液 、淀粉碘化钾溶液,完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: 。
假设2方案: 。
2、根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行?_ (填“行”或“否”),理由是:_______________________________ 。
3、 若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为: 。
四、本题包括2小题,共16分。
16.(10分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
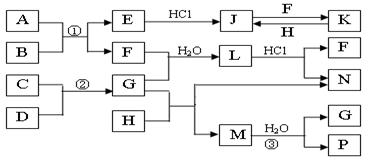
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
17.(6分)室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过
量。
(1)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白:
| 离子浓度由大到小的顺序 | 溶质的化学式 | 溶液的pH | |
| ① | c(NH4+)>c(Cl—)>c(OH-)>c(H+) | pH>7 | |
| ② | c(NH4+)=c(Cl-) | NH4Cl、NH3·H2O | |
| ③ | NH4Cl | pH<7 | |
| ④ | c(Cl—)>c(H+)>c(NH4+)>c(OH-) | pH<7 |
五、本题包括1小题,共10分。
18.(10分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
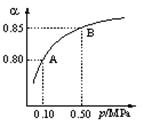 (1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)![]() 2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
① 将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
② 平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g); DH =-1160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
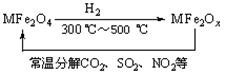 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M
为Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M
为Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必
配平)。
六、本题包括1小题,共10分。
19.(10分)含氮化合物及惰性气体在医疗和环保领域都有十分广泛的应用。
(1)作为麻醉剂,氙气在医学上很受重视,氙能溶解细胞质的油脂,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止。人们曾试用体积分数为80%的氙气和20%的氧气组成混合气体作为无毒副作用的麻醉剂。氙在元素周期表中位于第 周期, 族。
(2)笑气(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2具有相似的结构(包括电子式)。
①已知N2O分子中的氧原子只与一个氮原子形成化学键,则其空间构型是 型,N2O为 分子(填极性或非极性)。
②N2O可由NH4NO3在加热条件下(100℃以上)分解产生,产物除N2O之外还有一种物质,则此反应的化学方程式为 。该反应常伴有副
(3)汽车尾气会形成光化学烟雾,用C3N3(OH)3消除汽车尾气中的NO2,其化学原理为:
C3N3(OH)3=3HNCO,生成的HNCO再与NO2反应,得到三种无毒性的物质,从而大大降低了汽车尾气对环境的污染。
① 试写出HNCO与NO2反应的化学方程式: ;
② 1molNO2在反应中转移的电子为 mol。
七、本题包括1小题,共12分。
20.(12分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体(气体的体积均为标准状况下的体积)。
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL。
①生成沉淀的最大质量是__ ___g;沉淀恰好全部溶解时消耗CO2的体积为__ ___mL。
②原混合物中KOH的质量为________g。
(2)若KOH和Ca(OH)2以任意比混合,总质量仍保持1.3g不变,通入CO2气体至无沉淀时,最多则消耗CO2的总体积V(mL)的取值范围为_______ ___。
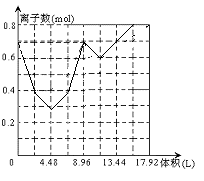
 (3)某溶液中有和0.2mol KOH 0.1mol Ca(OH)2, 往溶液中持续通入CO2, 当CO2刚足量时,立即改通NH3, 作出通入气体总体积与溶液中离子总数的图象。(不考虑气体在水中的溶解度,离子水解和水的电离均忽略不计)
(3)某溶液中有和0.2mol KOH 0.1mol Ca(OH)2, 往溶液中持续通入CO2, 当CO2刚足量时,立即改通NH3, 作出通入气体总体积与溶液中离子总数的图象。(不考虑气体在水中的溶解度,离子水解和水的电离均忽略不计)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
21A。物质结构与性质
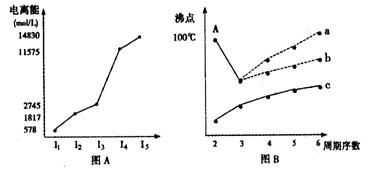
(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
|
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、
话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结
构示意图如右图,它的化学式是 ;
晶体内与每个“Ti”紧邻的氧原子数为 个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,
另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这
两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶
液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。
则绿色晶体配合物的化学式为 。
21B.实验化学
(12分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6—n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

| |
(1)搅拌加热操作过程中发生反应的离子方程式 ;
。
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)升高pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A、NaOH B、Al C、氨水 D、Al2O3 E、NaAlO2
高三第二次调研测试试卷答案
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | C | D | A | D | A | C | C |
二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。
| 9 | 10 | 11 | 12 | 13 | 14 |
| AC | C | D | BD | AB | A |
三、本题包括1小题,共11分。
15.(12分)
1、(1)Br2;Fe3+ (每空2分,共4分)
(2)假设1方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设2方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
2、假设2 (1分);不可行(1分);因为Br2和Fe3+都能把I—氧化成I2使溶液都变蓝,无法得出结论。(2分)
3、2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
四、本题包括2小题,共16分。
16.(10分)
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O![]() H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
17.(6分)
(1)增大,减小 (每空1分,共2分)
(2)①NH4Cl、NH3·H2O; ②pH=7 ③c(Cl—) >c(NH4+)>c(H+)>c(OH-)
④NH4Cl、HCl(每空1分,共4分)
五、本题包括1小题,共10分。
18.(10分)
(1)①800(2分), ② =(2分)。
(2)1.60NA(或1.6NA) (2分);173.4(2分)。
(3)MFe2Ox+SO2![]() MFe2O4+S。(2分)
MFe2O4+S。(2分)
六、本题包括1小题,共10分。
19.(10分)
(1)五 0 (各1分,共2分)
(2)① 直线 极性 (各1分,共2分)
② NH4NO3 N2O↑+2H2O↑(2分)
(3)②8HNCO+6NO2 = 7N2+8CO2+4H2O(2分)
③ 4(2分)
 七、本题包括1小题,共12分。
七、本题包括1小题,共12分。
20.(1)① 1(2分);672(2分)② 0.56(2分)
(2)520∽787(2分)
(3)见右图(4分,部分正确酌情给分)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
21A.物质结构与性质(12分)
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ·H2O(3分)
21B.实验化学 (12分)
(1)Al2O3+6H+==2Al3++3H2O, 2Al+6H+==2Al3++3H2↑ (4分,各2分)
(2)过滤 (2分) (3)H2 (1分) (4)HCl(1分)
(5)促进AlCl3水解,使晶体析出。(2分)(6)BD (2分,少或错一个扣一分,不出现负分)