高考化学教学质量检测卷
6.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是
A. 铜和稀硝酸反应 B.氮气和氧气发生反应
C. 二氧化氮气体溶于水 D. 氨的催化氧化
7. 对达到平衡状态的可逆反应:X+Y![]() W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是
W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是
A.X、Y、W为气体,Z不是气体
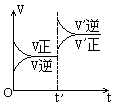 B.X、Y为气体,W、Z中有一种是气体
B.X、Y为气体,W、Z中有一种是气体
C.W、Z为气体,X、Y中有一种是气体
D.W、Z中有一种为气体,X、Y都不是气体
8. 在传统的硝化法制硫酸中,其关键反应为NO2+SO2=NO+SO3,2NO+O2=2NO2,SO3+H2O=H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是
A.H2SO4> NO2> O2 B.O2> SO3> H2SO4 C.NO2> O2> SO3 D.O2> NO2> SO3
9.青霉素试验针用它的稀溶液(200国际单位青霉素/mL)。现有1小瓶20万国际单位青霉素,1.0mL注射器(分刻度为0.1mL),注射用水和几个干净小瓶。现吸取1.0mL注射用水注入第1瓶内溶解青霉素。吸取0.1 mL溶液在第2 小瓶中用水稀释成1.0mL。再吸取0.1mL在第3小瓶中稀释成1.0mL。又……在第几小瓶中青霉素浓度为200国际单位/mL。
A.3 B.4 C.5 Dv6
10.下列各组离子,在指定环境中一定能大量共存的是
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3―
C.能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
D.由水电离出的[OH-]=10-13mol/L的溶液中:Fe3+、NH4+、ClO-、Cl-
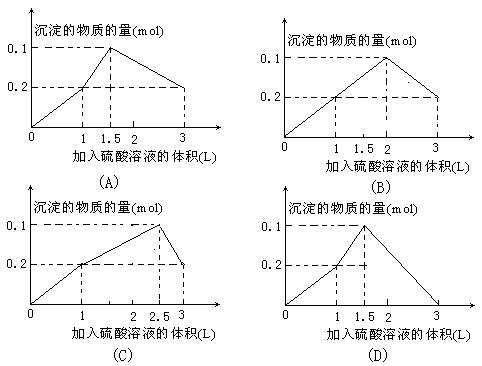
11.在1L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1的H2SO4溶液,所产生的沉淀的物质的量和所加入硫酸溶液的体积关系可用下列图像表示的是
12.设NA为阿伏加德罗常数,钠的摩尔质量为M g·mol -1,钠的密度为![]() g·cm-3,则以下说法中,正确的是
g·cm-3,则以下说法中,正确的是
①1 g Na所含原子数为![]() 个 ②1 cm3 Na所含原子数为
个 ②1 cm3 Na所含原子数为![]() ③1个钠原子的质量为
③1个钠原子的质量为![]() ④1 个钠原子占的体积为
④1 个钠原子占的体积为![]() ⑤1 g钠在足量O2中燃烧失去的电子数为
⑤1 g钠在足量O2中燃烧失去的电子数为![]()
A.①② B.②③④ C.①②④ D.③④⑤
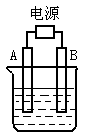
13.如右图所示,A、B为石墨电极,烧杯中加入的是只含一种溶质的电解质溶液500 mL,接通直流电源后,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;则下列判断正确的是
A.A电极的名称为阳极
B.B电极上的电极反应为2H++2e-==H2↑
C.总反应的离子方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.电解一段时间后溶液的pH会升高
26.(15分) A、B、C是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种最高价含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
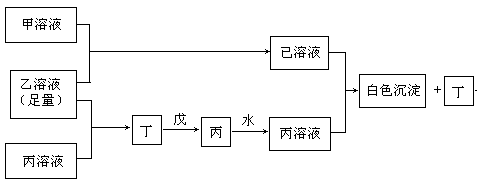
回答下列问题:
(1)写出A、B、C三种元素的元素符号 、 、 。
(2)写出戊的电子式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲 ;乙+丙 。
(4)写出已溶液和丙溶液反应的离子方程式: 。
27.(14分)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显 性,相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
(A)c(Na+)>c(CH3COO-) (B)c(CH3COO-)> c(Na+) (C)c(OH-)> c(Na+)
(D)c(Na+) > c(OH-) (E)c(OH-)> c(CH3COO-) (F)c(CH3COO-)> c(OH-)
(4)若溶液中含有物质的量相等的两种溶质,且该溶液中加入少量的强酸或少量的强碱时,溶液的pH几乎不变,试解释原因 。
28.(16分)为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
(1)该清液滴在有色布条上有极强的漂白作用。
(2)该清液中滴加碳酸钠溶液产生白色沉淀。
(3)该清液中滴加盐酸可产生大量气体。
(4)该清液加热后变浑浊并产生大量气体。
实验三:该学生设想用下列装置收集实验二中产生的气体作进一步检验。
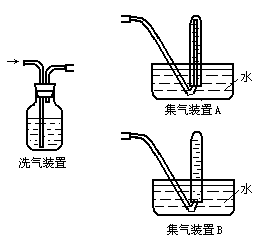
回答下列问题:
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有 (写化学式)。
(2)在实验二中,清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有 离子。
(3)在实验二中,清液中滴加盐酸产生的气体是 。
(4)在实验二中,清液加热后产生浑浊的原因是因为生成了 物质。
(5)实验三中,洗气装置内的洗涤液一般用 溶液。
(6)在反应物的量相同情况下,该学生尝试用集气装置A和集气装置B分别和洗气装置相连来收集气体。选用集气装置 (选填“A”或“B”)可收集到更多的气体。
(7)经试验,该学生最终选用集气装置B进行下一步实验。其选择装置B的原因是 。
(8)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为 。
29. (15分)有机物A的化学式为C9H16O4,且分子内无支链。有机物B和A结构相似,A→K相互间转化关系如下图所示(转化过程中产生的无机物均已略去):
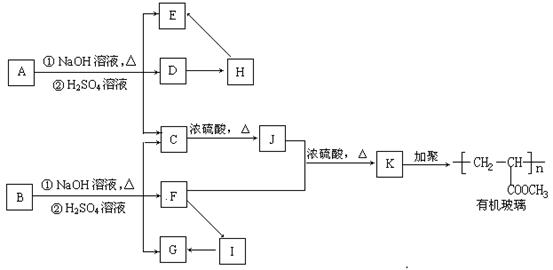
请回答下列问题:
(1)A→K 十一种有机物中属于酯类的是 (填对应的字母)。
(2)A→K 十一种有机物中有 对物质可互称为同系物。
(3)A→K 十一种有机物中可发生银镜反应的物质有 (填对应字母)。
(4)B的结构简式为 。
(5)C→J该反应的类型是 反应。
(6)C在适当的条件下(无其它反应物),也可形成有机高分子化合物,该有机高分子化合物的结构简式为 。
参考答案和评分标准
6.B 7.C 8.D 9.B 10.C 11.A 12.B 13.C
![]() 26. (1)C、Al、S (3分)(2)
(3分)
26. (1)C、Al、S (3分)(2)
(3分)
(3)AlO2-+H++H2O===Al(OH)3↓ (3分) CO32-+H+==HCO3-(3分)
(4)2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑ (3分)
27.(1)碱性(2分) CH3COO-+H2O![]() CH3COOH+OH- (2分)
CH3COOH+OH- (2分)
(2)CH3COOH、CH3COONa (4分) (3)B、C (4分)
(4)该溶液中存在平衡体系:CH3COOH![]() CH3COO-+H+,当加入少量强酸,溶液中的CH3COO-和强酸电离的H+结合,使平衡左移,c(H+)不会显著增大;当加入少量强碱时,溶液中的H+和强碱电离的OH-结合生成水,使平衡右移,c(H+)也不会显著增大。(2分)
CH3COO-+H+,当加入少量强酸,溶液中的CH3COO-和强酸电离的H+结合,使平衡左移,c(H+)不会显著增大;当加入少量强碱时,溶液中的H+和强碱电离的OH-结合生成水,使平衡右移,c(H+)也不会显著增大。(2分)
28.(1)HClO (2)Ca2+ (3)CO2 (4)CaCO3 (5)饱和NaHCO3 (6)A
(7)选用B装置操作较为简便。若选用A装置将导管移出试管时,会造成大量气体逃逸且操作也不方便。
(8)2CaCO3+Cl2+H2O===Ca(HCO3)2+2HClO+CaCl2
(每小题各2分,共16分)
29.(1)A、B、K (3分) (2)4 (2分) (3)B、H、G、I (4分)
(4)HCOOCH2CH2COOCH3 (2分)(5)消去 (2分)
![]()
(6) (2分)