高三理科基础——化学复习提纲5
第二章 化学物质及变化-3-氧化还原反应
一、氧化还原反应
1. 氧化还原反应的特征:有元素化合价的升降(不一定有氧的得失)
2. 氧化还原反应的本质:有电子转移(得失或偏移)
3.
氧化还原反应识记: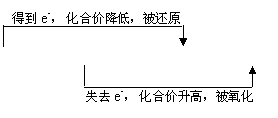
(1)助记模型: 氧化剂 + 还原剂 —— 还原产物 + 氧化产物
|
![]()
![]() 例:
例: ![]()
|
(2)助记口决:
失升氧,得降还;若问剂,则相反。
有得必有失,得失要相等;易失难得。
4. 物质的氧化性,还原性的相对强弱的判断:
(1) 通过实际氧化还原进行判断:
氧化性: 氧化剂 > 氧化产物
还原性: 还原剂 > 还原产物
(2)通过金属活动性顺序判断:
 K Ca Na
Mg Al Zn Fe Sn Pb
( H ) Cu Hg
Ag Pt Au
K Ca Na
Mg Al Zn Fe Sn Pb
( H ) Cu Hg
Ag Pt Au
(3)通过非金属活动性顺序判断:

![]() S I Br Cl O F
S I Br Cl O F
5. 有关氧化反应的计算:
根据氧化还原反应进行简单计算的实质:
(氧化剂)得电子总数=(还原剂)失电子总数
附录:常见元素化合价口诀:
K Na H Ag +1价,F Cl Br I -1价;
Ca Mg Zn Ba +2价,通常氧是 -2价;
Cu 有+1和+2, Al +3 ,Fe 有+2和+3
C 有+2和+4, S有-2,+4,+6
单质中元素的化合价都为0,化合物中元素的化合价代数和为0
学 生 课 堂 笔 记
随 堂 练 习
1.一定条件下,氨气与一氧化氮发生反应4NH3+6NO=5N2+6H2O。该反应中化合价降低的元素是
A.NH3中的N B.NO中的O C.NO中的N D.NH3中的H
2.火星中存在一种含铁元素的矿物,化学式为KFe3(SO4)2(OH)6,其中Fe元素的化合价为
A.+2 B.+3 C.0 D.-2
3.在氧化还原反应中,下列叙述不正确的是
A.物质失电子的反应为氧化反应 B.物质在变化中失去了电子,此物质是氧化剂
C.发生电子转移的反应一定是氧化还原反应 D.发生化合价升降的反应一定是氧化还原反应
4.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是..............
A.化合反应一定是氧化还原反应 B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应 D.复分解反应不一定是氧化还原反应
5.下列反应中,铁元素发生氧化反应的是
A.FeS +2HCl = FeCl2 + H2S↑ B. Fe +H2SO4 = FeSO4 +H2↑
C. FeO + 2HCl =FeCl2 + H2O D. Fe2O3 +3CO = 2Fe +3CO2
6.下列反应中必须加入还原剂才能进行的是
A.CuO→CuCl2 B.Zn→ Zn2+ C.H2→H2O D.Cl2→Cl-
7.在下列反应中 HCl 作氧化剂的是
A.NaOH+HCl=NaCl+H2O B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
8.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
A.Na2S B. S C. SO2 D. H2SO4
9.在2FeBr2+3Cl2![]() 2FeCl3+2Br2的反应中,被氧化的元素是
2FeCl3+2Br2的反应中,被氧化的元素是
A.Fe B.Br C.Fe和Br D.Cl
10.在2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O反应中,还原产物是
2KCl+2MnCl2+5Cl2↑+8H2O反应中,还原产物是
A.KCl B.MnCl2 C.H2O D.Cl2
11.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A.Na+、Ba2+、Cl-、SO42- B. Ca2+、HCO3-、C1-、K+
C.MnO4-、K+、I-、H+ D. H+ 、Cl- 、Na+ 、CO32-
12.下列反应中,属于非氧化还原反应的是
A. 3CuS+8HNO3 =3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 3Cl2+6KOH =5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH =2K2CrO4+4H2O
D. 3CCl4+K2Cr2O7 =2CrO2Cl2+3COCl2+2KCl
13.氧化还原反应发生在同种元素之间的是
A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S+2H2O
C. H2+CuO=Cu +H2O D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
14.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
15.P单质在反应4P+3KOH+3H2O![]() 3KH2PO2+PH3中是
3KH2PO2+PH3中是
A.被氧化 B.被还原
C.既被氧化又被还原 D.既未被氧化又未被还原
16.下列反应中硫酸既表现了氧化性,又表现了酸性的有
A.2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)十C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaCl![]() NaHSO4+HCl↑
NaHSO4+HCl↑
D.H2SO4+Na2SO3![]() Na2SO4+H2O+SO2↑
Na2SO4+H2O+SO2↑
17.1962年,英国青年化学家巴特来特将PtF6加入Xe中,按等微粒个数之比在温室下混合后,首次制得含有化学键的稀有气体化合物六氟合铂酸氙:Xe + PtF6 → XePtF6,已知XePtF6中Pt的化合价为+4价。有关此反应的叙述中,正确的是
A.Xe是氧化剂 B.PtF6是氧化剂
C.PtF6既是氧化剂,又是还原剂 D.该反应是非氧化还原反应
18.某元素在化学反应中由游离态变为化合态,则该元素
A.一定被氧化 B.一定被还原
C.既不可能被氧化,又不可能被还原 D.既可能被氧化,又可能被还原
19.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
20.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2CaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓
D.C+CO2![]() 2CO
2CO
21.氧化还原反应在生产、生活中具有广泛的用途。下列事例不属于氧化还原反应的是
A.金属冶炼 B.燃放鞭炮 C. 食物腐败 D.点制豆腐
*22.金属加工后的废切削液中含2—5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步: NaNO2+NH4Cl=NaCl+NH4NO2 第二步: NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
① NH4NO2只是氧化剂 ② NH4NO2只是还原剂 ③ NH4NO2发生了分解反应 ④ 只有氮元素的化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
*23.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有以下的转换关系(未配平)
(1) G ® Q+NaCl
(2) Q+H2O
![]() X+H2
X+H2
(3) Y+NaOH ® G+Q+H2O (4) Z+NaOH ® Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为
A. QGZYX B. GYQZX C. GYZQX D. ZXGYQ
*24.根据下列反应判断有关物质还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4 ②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=Fe(NO3)3+2FeCl3+2H2O+NO
A. H2SO3>I- >Fe2+ >NO B. I- >Fe2+ >H2SO3>NO
C. Fe2+ >I- >H2SO3>NO D. NO>Fe2+ >H2SO3>I-
*25.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A.5∶3 B.5∶4 C.1∶1 D.3∶5