第4课时 化学实验方案的设计与评价(B卷)
易错现象
1.忽视实验过程中的隐蔽性操作,对装置观察不仔细而造成答题失误。
2.对实验基本技能的掌握较差,对物质性质的认识不全面,对仪器的作用的认识存在局限性,对实验结果的定量处理能力不强。
3.审题不清,对实验现象的描述表达不清,设计物质检验方案的反应原理不清,语言表达能力差。
4.缺乏对物质的性质、制备、检验和综合实验方案设计与评价的统筹安排,知识的迁移能力和整合能力较弱,分析问题的能力不强。
纠错训练
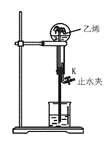 1.如下图的烧瓶中收集了一瓶乙烯,请你根据喷泉原理和乙烯化学性质,在图示基础上设计一个方案,使它产生喷泉,力求使水充满整个烧瓶。(简述原理与操作)
1.如下图的烧瓶中收集了一瓶乙烯,请你根据喷泉原理和乙烯化学性质,在图示基础上设计一个方案,使它产生喷泉,力求使水充满整个烧瓶。(简述原理与操作)
2.某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由浓H2SO4与Na2SO3反应制取,Na2O2完全反应。
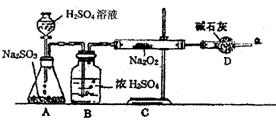 (1)怎样确定反应中是否有O2生成?
(1)怎样确定反应中是否有O2生成?
;
(2)装置B的作用是
;
装置D的作用是 ;
(3)该同学为了确定另一产物是Na2SO3还是Na2SO4,设计实验如下:
 |
你认为该同学的实验是否合理 ,理由 。
若你认为不合理,请你设计一个合理实验来确定产物(括号内填加入物质,方框内填现象);若你认为合理,可不回答此问。
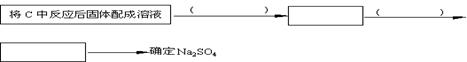 |
检测提高
1.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,试设计一个实验方案,既除去杂质,又配成硝酸钠溶液。
供选用的试剂有:①稀HCl ②稀HNO3 ③稀H2SO4 ④NaOH溶液 ⑤Na2CO3溶液 ⑥BaCl2溶液 ⑦Ba(OH)2溶液 ⑧Ba(NO3)2溶液
供选用的实验操作有:A.加热 B.过滤 C.分液 D.蒸发 E.蒸馏 F.结晶
要求:试剂不超过三种,空格按要求填人试剂或操作的序号,可不填满。
实验方案:先将固体溶于蒸馏水配成溶液,然后填下列空格:
选择试剂
选择操作
2. 实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的 化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | |||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
3.选择使用下列仪器、药品验证由铜和适量浓硝酸反应
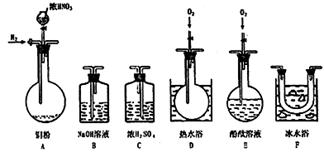 |
产生的气体中含有NO(N2和O2的用量可自由控制)
已知:Ⅰ NO+NO2+2OH-=2NO2-+H2O
Ⅱ气体液化温度NO2:21℃, NO:-152℃
(1)现有甲、乙、丙3位同学分别设计了以下3个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
请回答:甲、乙、丙3位同学提出的实验方案是否能验证Cu与适量浓硝酸反应,产生的气体中含有NO(填“能”或“不能”)。
甲 ,乙 ,丙 ;
(2)反应前先通足量N2,其目的是 ;
(3)确认气体中含有NO的现象是 。
4.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
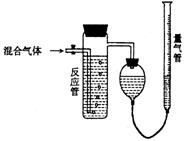 (1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
![]() a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
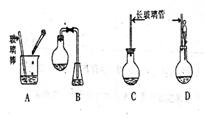
![]() 5.1,2,3,4—四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
5.1,2,3,4—四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
 回答下面问题:
回答下面问题:
(1)下面示意图中的装置,适合步骤①和②操作的是 ;
(2)步骤②中如何判断“反应完全” ;
(3)步骤③中补充少量四氢化萘的目的是 ;
(4)步骤③中过滤后得到的固体物质是 ;
(5)已知在实验条件下,饱各氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中四氢化萘和水的质量比约是1: (保留小数点后1位)。
|
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
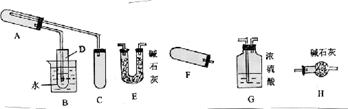 现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
(Ⅰ)测定该粉末组成中结晶水的x值;
(Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(1)见图中已装配好一套装置,回答下列问题:
①该装置用于进行实验(选填Ⅰ或Ⅱ) ,需加热的仪器有(选填序号字母) ;
②在试管D中所放试剂及可观察到的现象是 ,
反应的离子方程式为 ;
③为确保反应物有较高的利用率,且使装置中气流平稳,应对C部分进行的改进是 ;
(2)用图中其它仪器组装完成另一实验的装置,回答以下问题:
①这些仪器按气流从左到右方向的连接顺序是(填写序号字母) → → →H;其中H的作用是 ;
②组装试管F时,试管口应略向下倾斜,其原因是 ;
(3)若各装置中的反应都能进行完全,实验后测得A中固体质量减轻ag、E增重bg、G增重cg,则表示结晶水x值的计算式为(从a、b、c中选两个量求算,不必化简) 。
答案分析:
纠错训练
1.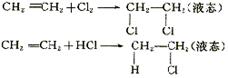 方法1:先在一个气球内充入与烧瓶等体积的Cl2或HCl气体。打开止水夹K,从图中止水夹K处将气体缓缓送入烧瓶内,因为
方法1:先在一个气球内充入与烧瓶等体积的Cl2或HCl气体。打开止水夹K,从图中止水夹K处将气体缓缓送入烧瓶内,因为
方法2:打开止水夹K,注入适量溴水,
讲析:先使烧瓶内乙烯转化成液态物质,使瓶内气态物质分子数趋于零既可产生喷泉,且使水充满整个烧瓶。
2.(1)用带火星的木条靠近干燥管口a,观察是否复燃。
(2)干燥SO2,防止水蒸气进入C装置与Na2O2反应;
防止空气中水蒸气进入C装置与Na2O2反应生成O2;同时吸收过量的SO2,防止干扰O2的检验和污染空气。
(3)不合理,固体中有Na2SO3时也具有此现象
(4)盐酸,无明显现象 BaCl2溶液或Ba(NO3)2溶液,白色沉淀
检测提高
1.选择试剂 ⑦ ⑤ ②
选择操作 A B A
讲析:杂质NH4+和HCO3-用OH-除去,杂质SO42-用Ba2+除去,综合考虑用Ba(OH)2溶液最佳,此时产生了BaCO3、BaSO4沉淀及NH3·H2O,用加热法使NH3·H2O分解而除去,考虑到除杂试剂过量,用Na2CO3溶液使多余的Ba2+成为BaCO3沉淀,将两步产生的沉淀一起过滤,减少了操作步骤。最后用适量稀HNO3除去OH-、CO32-,再加热赶掉溶解在其中的CO2即可。符合题中要求选用试剂不超过3种,操作简单且步骤少,既除杂又配成NaNO3溶液。若开始选用NaOH溶液、Ba(NO3)2溶液,则选用试剂超过3种。
2.
| 实验方法 | 实验过程中所发生 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | H2SO4+Zn=ZnSO4+H2↑ H2+CuO | ①②③⑦ | 实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
| 2 | H2SO4+CuO=CuSO4+H2O | ①⑤⑧⑨ | 过滤后剩余固体的质量 |
| 3 | 2Cu+O2 | ①④⑥⑦⑧ | 实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也可以)
3.(1)能; 不能; 不能。
(2)排尽整个装置中的空气,防止产生的NO被空气中的O2氧化
(3)(D)装置中通入O2后有红棕色气体生成
讲析:一般验证NO气体的方法是:使它与O2接触,发生反应生成红棕色NO2气体,由颜色变化可以判断原来有无NO存在。要验证铜和适量浓硝酸反应产生的气体中含有NO,而该反应产生的气体主要成分是NO2,这就是说要从NO和NO2的混合气体中验证NO的存在。为此要做到:①反应前应将装置内空气赶尽,防止NO被氧化;②将混合气体中NO和NO2分离,可由题给的NO和NO2的液化温度,通过F装置完成;③反应混合气中少量的水蒸气冷凝后溶解NO2,会产生NO,需对混合气进行干燥,这可由C装置完成。
4.(1)N2、O2的体积 (2)偏低
(3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也对)
(5)bceg或beg或ceg
5.(1)D(2)加入的液溴颜色基本不褪(3)除去过量的溴(4)四氢化萘、铁粉(5)1.3
讲析:本题主要考查考生对实验目的、原理是否理解,同时考查考生能否仔细审题和利用题目中提供的信息来解答问题。
按照步骤①,本实验是把四氢化萘、水和铁粉加入同一容器中进行反应,所以B不是正确选项。若用A中的装置进行反应,溴蒸气和刺激性气味的四氢化萘都会污染环境,同样C装置在步骤②反应时,也会造成环境污染,所以A和C都不是正确选项。正确选项是D。根据题中所提供的信息,四溴化萘是不溶水的固体,四氢化萘和氢溴酸溶液都是无色的,反应完全时,四氢化萘已基本消耗完,加入的溴溶于水中使溶液呈棕黄色。在步骤③中补充少量四氢化萘则是为了除去溶液中过量的溴。从题中可知过滤后得到的固体物质只能是四溴化萘和作为催化剂的铁粉。由反应方程式可知,1 molC10Hl2(132 g/mol)与溴反应后产生4molHBr(81 g/mol),又知反应条件下得到的氢溴酸饱和溶液中HBr的质量分数是66%,所以含4molHBr的饱和溶液中水的质量是(81×4)×34%÷66%,所以步骤①中四氢化萘和水的质量比应是: 132:[(81×4)×34%÷66%]=1:1.3
6.(1)①Ⅱ ABC ② 银氨溶液;试管内壁产生银镜
![]() CH3CHO + 2[Ag(NH3)2]+
+ 2OH— CH3COO— + NH4+
+2Ag↓+ 3NH3
+2H2O
CH3CHO + 2[Ag(NH3)2]+
+ 2OH— CH3COO— + NH4+
+2Ag↓+ 3NH3
+2H2O
③ 水浴加热,温度计控温78℃或略大于78℃
(2)① F、G、E防止空气中H2O和CO2进入E,引起测定误差 ② 防止加热时产生的水蒸气在试管口部分冷凝回流支试管底部,引起炸裂
![]()
![]() (3)
或
(3)
或