第2课时 常见物质的实验室制法(B卷)
易错现象
1.常见气体的制备反应原理不熟悉,忽视了对反应试剂及反应条件的要求。
2.净化气体的顺序颠倒,带来新的杂质气体,甚至除去了所需气体。
3.没有根据气体的性质选择正确的尾气吸收装置。
4.观察不仔细,没有明确基本原理,在连接装置问题上错答。洗气时应是“长进短出”,而量气时才是“短进长出”。
纠错训练
1.今有下列气体:①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2,用右图装置进行实验,填写下列空白:
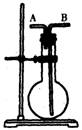 (1)若烧瓶是干燥的,则由A口进气可收集的气体是 ;由B口进气可收集的气体是
。 (用序号表示,下同)
(1)若烧瓶是干燥的,则由A口进气可收集的气体是 ;由B口进气可收集的气体是
。 (用序号表示,下同)
(2)若烧瓶充满水,可用来测量 气体的体积,这时气体由 口进入。
(3)若在烧瓶内装入浓硫酸进行干燥气体,则可用此装置进行干燥的气体有 ,这时气体由 口进入。
(4)若烧瓶是干燥的,不能用此装置来收集的气体是 。
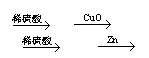 2.在实验室中,用锌、氧化铜、稀硫酸为原料制取铜,有下列两种途径:
2.在实验室中,用锌、氧化铜、稀硫酸为原料制取铜,有下列两种途径:
①Zn H2 Cu
②CuO CuSO4 Cu
若用这两种方法制得铜的质量相等时,下列叙述中符合实际结果的是( )
A.消耗相同质量的硫酸 B.消耗相同质量的锌
C.消耗相同质量的氧化铜 D.生成硫酸锌的质量相同
3.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是 (多选扣分)。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(a) (b) (c) (d)
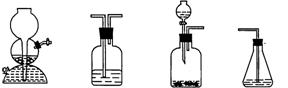
→ b → → d
(电石、水) ( ) ( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
检测提高
![]() 1.下列反应适用于实验室制备氧气的是( )
1.下列反应适用于实验室制备氧气的是( )
![]()
![]() ①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+O2
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+O2
②硝酸铵热分解 2NH4NO3 4H2O+2N2+O2
③过氧化氢催化分解 2H2O2 2H2O+O2
④二氧化氮热分解 2NO2 = 2NO+O2
A.只有① B.①和② C.①和③ D.①③④
2.实验室制取下列气体,其发生装置和收集装置均相同的是( )
A.H2和Cl2 B.CO2和NO2
C.O2和NH3 D.C2H4和C2H2
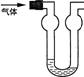 3.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。右图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是( )
3.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。右图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是( )
A.Cl2 B.HCl C.H2S D.CO2
附:四种气体的溶解度表(室温下)。
| 气体 | Cl2 | HCl | H2S | CO2 |
| l体积水约能吸收气体体积数 | 2 | 500 | 2.6 | 1 |
4.设计了四种气体制备的方案:①加热稀硫酸和乙醇制备乙烯;②用锌和稀硝酸制备氢气;③用稀硫酸和大理石制备二氧化碳;④用浓硝酸和亚硫酸钠制备二氧化硫。不宜采用方案有哪些?
A.只有①和② B.只有②和③
 C.只有②和④ D.①②③④
C.只有②和④ D.①②③④
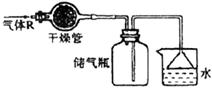
5.实验室里可按下图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
A.NO2 B.HCl C.CH4 D.NH3
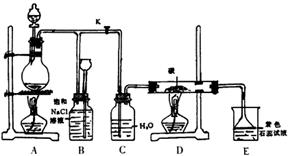 6.下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
6.下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(1)A为氯气发生装置,写出反应的化学方程式
_______________________________________
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(气),试写出D装置中反应的化学方程式_________________________________;装置C的作用是______________。
(3)E处石蕊试液的现象是 ,
其原因是 。
(4)若将E处溶液改为石灰水,反应过程的现象是___________________
(A)有白色沉淀生成 (B)无白色沉淀生成
(C)先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,
B的作用是___________________________________。
7.某化学课外小组欲用固体和液体反应(不需加热),快速简便地制取一瓶干燥的氧气:
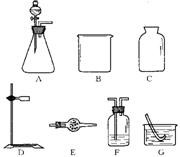 (1)从所提供的仪器(或装置)A~G中,选出所需的(填序号)
(1)从所提供的仪器(或装置)A~G中,选出所需的(填序号)
(注:图中未画出导气管、橡皮管、玻璃片等用品)。
(2)写出用此装置制取氧气发生反应的化学方程式 ;
(3)判断氧气是否收集满的方法(或现象) 是 ;
(4)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请于下表中写出还可用此装置制取的2种其他气体及制取该气体所需的试剂。
| 气体 | 所需试剂 | |
| ① | ||
| ② |
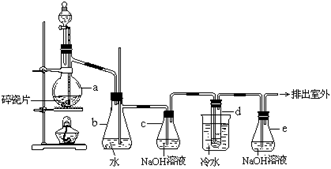 8.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
8.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: 。
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因 。
9.今用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Al2(SO4)3 + 6NaOH = 2Al(OH)3↓+ 3Na2SO4
②2Al + 2NaOH + 2H2O==2NaAlO2 + 3H2↑
2NaAlO2 + H2SO4 + 2H2O==2Al(OH)3↓+ Na2SO4
(1)请问上述哪一种方法比较节约试剂?(提示:试从每生产2 mol Al(OH)3所耗费的试剂用量予以说明。)
(2)原料相同,请设计一种更为节约试剂的方法(以化学方程式表示,并说明其可以最节约试剂的根据)。
答案分析:
纠错训练
1.(1)①③⑤;②④⑦⑧ (2)①③⑥,A
(3)①②③④⑥⑧,B (4)⑥
讲析:气体的收集方法有:①向上排空气法(收集密度比空气大的气体);②向下排空气法(收集密度比空气小的气体);③排水集气法(收集难溶于水的气体)。
利用两导气管的长短可判断采用何种收集方法。
2.C 讲析:由铜元素守恒,可知C正确。H2还原CuO的实验操作要求是:先通入H2排空气,加热反应后得到的Cu要在H2流中冷却,所需H2比反应消耗的H2要多,则A、B、D不正确。
3.(1)CaC2+2H2O→C2H2↑+ Ca(OH)2
HC≡CH+Br2→![]()
(或HC≡CH+2Br2→![]() )
)
(2)不能 a、c
(3)H2S Br2+H2S = S↓+2HBr
(4) c b
(CuSO4溶液) (CuSO4溶液)
(5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
检测提高
1.C 2.B 3.B 4.D 5.D
讲析:3.观察双球洗气管中的液面,再分析表格中四种气体的溶解度数据,可知是极易溶于水的气体表现的性质。4.制备乙烯用浓硫酸和乙醇;稀硝酸具有强氧化性,与锌反应不可能制得H2;大理石与稀硫酸反应生成的CaSO4微溶,覆盖在大理石的表面,阻止反应继续进行;浓硝酸具有强氧化性,将Na2SO3氧化,不能制得SO2。5.全面分析气体的干燥、收集和尾气处理装置,只有NH3符合。
6.(1)![]()
(2)![]()
提供D处所需的水蒸气
(3) 石蕊试液先变红色,后变无色;生成的HCl使石蕊试液变红。未反应完的Cl2与H2O作用产生HClO,HClO的漂白作用使红色消失。
(4)(B)
(5)瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境的污染。
讲析:答题时仔细阅读题设条件,通过推理可知D中发生反应需要水,则C装置的作用是:提供D处所需的水蒸气。回答E处现象时,要考虑未反应的Cl2与H2O作用;反应产物CO2与HCl同时通入石灰水中,大量HCl抑制CO2与石灰水反应。
7.(1)A、E(或F)、C
(2)2Na2O2+2H2O=4NaOH+O2↑或2H2O2 = 2H2O+O2↑
(3)取带火星的木条置于集气瓶口,木条复燃,证明已收集满
(4)①C2H2 CaC2和水(或饱和食盐水)
②NH3 浓氨水和CaO
③SO2 Na2SO3和硫酸
④HCl 浓硫酸和浓盐酸
![]() 8.(1)CH3CH2OH CH2=CH2↑+H2O
8.(1)CH3CH2OH CH2=CH2↑+H2O
CH2=CH2 +Br2→CH2 Br CH2 Br
(2)b中水面会下降,玻璃管中的水面会上升,甚至溢出。
(3)除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫。
(4)①乙烯发生(或通过液溴)速度过快 ②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以)
9.(1)第②种方法比较节约试剂。从化学方程式看出,同样是制备2 mol 的Al(OH)3,方法①所需原料为:2 mol Al,3 mol H2SO4,6 mol NaOH;而方法②所需原料为:2 mol Al,1 mol H2SO4,2 mol NaOH。
(2)① 2Al + 3H2SO4==Al2(SO4)3 + 3H2↑
② 2Al + 2H2O + 2NaOH==2NaAlO2 + 3H2↑
③ Al2(SO4)3+ 6NaAlO2 + 12H2O==8Al(OH)3↓+ 3Na2SO4
由方程式看出,制备8mol 的Al(OH)3,所需原料为:8
mol Al,3 mol H2SO4,6
mol NaOH。相当于制备2mol Al(OH)3,所需量为:2
mol Al,![]() mol H2SO4,
mol H2SO4,![]() mol NaOH,其用量为最少。
mol NaOH,其用量为最少。