专题(十七)探究实验的设计与评价
学习目标
1、能够根据实验试题的要求,设计和评价简单实验方案。
2、学会识别和绘制典型的实验仪器装置图。
3、培养各部分实验知识与技能综合应用的能力。
典型例题
![]() 例题1:实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO N2+3Cu+3H2O
例题1:实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO N2+3Cu+3H2O
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量(mCuO、mH2O)时,请用下列仪器设计一个简单的实验方案。
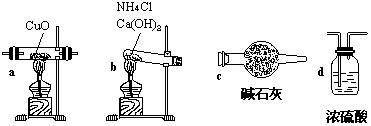 |
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ; d中浓硫酸的作用是 , ;实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 。(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有 。
(a)、mCu、mCuO (b) mN2、 mH2O (c)、mCu、mH2O (d)、mNH3、 mH2O
例题2:实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。试回答:
(1)B中反应的化学方程式为:__________________________________________;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:
___________________________________________________________________________。
(3)D中反应化学方程式为:_____________________________________________。
(4)装置(Ⅰ)的主要缺点是:__________________________________________ 。
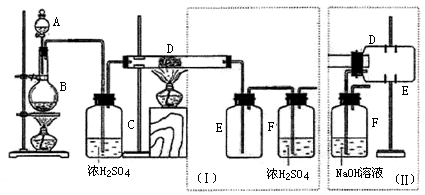
(5)装置(Ⅱ)的主要缺点是:_________________________________________。
如果选用此装置来完成实验,则必须采取的改进措施是:
____________________________________________________________________________。
课堂练习
1.为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是
A、甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B、乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C、丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D、丁同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
3.某溶液含有较多的 Na2SO4 和少量的 Fe2(SO4)3 ,若用该溶液制取芒硝,可供选择的操作有:①加适量 H2SO4 溶液②加金属 Na ③结晶④加过量 NaOH ⑤加强热脱结晶水⑥过滤。正确的操作步聚是 ( )
A.②⑥③ B.④⑥①③ C.④⑥③② D.②⑥①③⑤
4.某溶液中含有OH—、CO32—、SO42—三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法。
5.某研究性学习小组在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
⑴验证甲同学的推测是否正确的方法是_____________________________,验证乙同学的推测是否正确的方法是_____________________________________;当出现_________________________________________现象时,即可说明丙同学的推测正确。
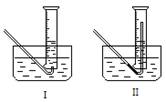 ⑵有同学提出用定量的方法探究丙同学方案中是否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
⑵有同学提出用定量的方法探究丙同学方案中是否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的______,理由是__________________________。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为________(选填“100mL”、“200mL”、“500mL”或“1000mL”)。
6.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为 ag.②装好实验装置。③检查装置气密性。④加热,开始反应,直到产生一定量的气体。⑤停止加热(如图,导管出口高于液面)。⑥测量收集到气体的体积。⑦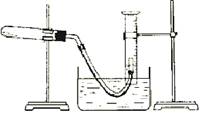 准确称量试管和残留物的质量为bg.⑧测量实验室的温度。⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:
准确称量试管和残留物的质量为bg.⑧测量实验室的温度。⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:
⑴如何检查装置的气密性? 。
⑵以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:
(请填写步骤代号)。
⑶测量收集到气体体积时,如何使量筒内外液面的高度相同?
。
7.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
8.CO2气体是大气产生温室效应、使地球变暖的气体之一。某学生参加课外环保小组,测定校办工厂排出废气中CO2(含杂质SO2)的含量,他准备将CO2变成沉淀,然后测沉淀质量,通过计算求出CO2的含量。图中表示主要装置,其他胶管、导管略去。
(1)下列设计主要仪器装置使用的顺序有两种,其中 方案较为合理。
甲方案;A→D→E→F→C 乙方案:A→D→F→E→C
(2)为什么要使气体两次通过酸性KMnO4溶液
(3)为什么没有选B装置
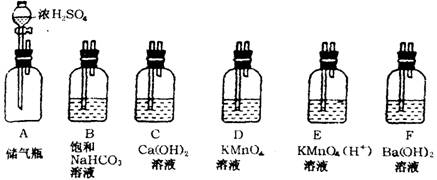
(4)CO2是被转化成 沉淀而计算出质量来的。
(5)要测得沉淀物质量需进行 、 、干燥、 操作。
课后练习
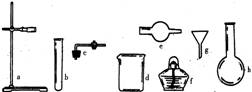 1.在没有现成的 CO2气体发生器的情况下,请你选用右图中的部分仪器,装配成一个简易的,能随开随用,随关随停的 CO2气体发生装置。应选用的仪器是(填入仪器的编号)(
)
1.在没有现成的 CO2气体发生器的情况下,请你选用右图中的部分仪器,装配成一个简易的,能随开随用,随关随停的 CO2气体发生装置。应选用的仪器是(填入仪器的编号)(
)
A.abcd B.degh C.bcd D.acde
2.以下气体:①H2 ②Cl2 ③CH4 ④NO ⑤SO2 ,(烧瓶的位置不能移动)
 (1). 若烧瓶是干燥的,则由A口进气,可收集的气体是 ,由B口进气,可收集的气体是 。
(1). 若烧瓶是干燥的,则由A口进气,可收集的气体是 ,由B口进气,可收集的气体是 。
(2). 若烧瓶内充满水,可收集到的气体是 ,气体应由 口进入(填A或B) (3). 若在烧瓶内装有一定量的溶液,用以洗气,则气体应从 口进入 (填A或B)
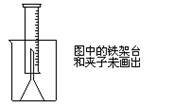 3.测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
3.测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
② ,
③ ,
④ 。
(2)合金样品用铜网包裹的目的是: 。
4.实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的 化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | |||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
5.某工厂废液经测定得知含有乙醇、甲醇、乙酸和乙酸乙酯。现欲从废液中回收甲醇、乙醇和乙酸,根据各物质的性质 (见下表) ,补充下列实验步骤,并回答有关问题:
| 物质 | 甲醇 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 65 | 77 | 78 | 118 |
可供选择的实验用品:250 mL 蒸馏烧瓶,400 mL 烧杯,250 mL 烧杯,温度计,冷凝器接受器,玻璃棒以及中学化学实验的常用仪器。1摩尔/LNaOH 溶液, 18.4 mol/LH2SO4 溶液,蒸馏水和冰
(1)补充下列实验步骤,直至达到实验目的。
第一步:组装蒸馏装置,检查其气密性;
第二步:取100 mL 废液注入250 mL 蒸馏烧瓶中,滴入1 mol/LNaOH溶液,调整废液的pH=10 ;
第三步:___________________________ 。
第四步:_______________________ 得甲醇。
第五步:_________________________ _得乙醇。
第六步:_____________________ 得乙酸。
(2)滴入 1 mol/LNaOH 溶液,使溶液的 pH=10 的目的是______________
。
(3)使用 18.4 mol/LH2SO4 目的是(用化学方程式表示)_____________________。
专题(十七)参考答案:例题例1 答案:(1)①b c a c d,吸收未反应的氨,防止空气中水分进入,固体由黑色转变为红色②(18 mCuO )/ mH2O –16 ③a、c (2)a、c
![]() 例2答案:
例2答案:
(1)4HCl+MnO2 MnCl2+2H2O+Cl2↑或16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2
![]() (2)B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D
(2)B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D
(3)2Fe+3Cl2 2FeCl3
(4)导管易被产品堵塞,尾气排入空气,易造成环境污染
(5)产品易受潮解 在瓶E和F之间连接装有干燥剂的装置(其他既能防止产品潮解又能防止尾气污染环境的合理答案均给分)
课堂练习
| 1A | 2D | 3B |
4.首先加入NH4NO3溶液,检验OH—;其次加入HNO3溶液(或盐酸),检验CO32—;最后加入Ba(NO3)2溶液,检验SO42—。
5.⑴冷却后加酚酞试液或冷却后看溶液是否变红 加水稀释后看溶液是否变红(或加较多的水反应后滴加酚酞试液看是否变红) 冷却后及加水稀释后均不变红
(2)①Ⅱ 防止气体冷却时发生倒现象,减小实验误差。 ②500mL
6.(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导①管,表明装置不漏气。
(2)②①③ (3)慢慢将量筒下移
(4)22.4L/mol×298K×(ag-bg)÷(273K×cL)
7.(1)100mL容量瓶(注:未标明规格的扣1分)
(2)>b(多选扣分)
(3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
8.(1)甲(2)使SO2尽可能被除去, E中溶液不褪色,确定SO2除尽
(3)NaHCO3与SO2反应会生成CO2,使原有CO2气体的质量增大
(4)BaCO3(5)过滤、洗涤、干燥、称量
课后练习
1.D
2.(1)H2 CH4 Cl2 SO2 (2)H2 CH4 NO A(3)B
3.(1)②往烧杯中注入水,直至水面没过漏斗颈。(没答水面没过漏斗颈不给分)
③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。(只要黑斜体中的要点全部答对给分,装满水的量筒怎样倒置在杯中可不作要求,答或不答不加分也不扣分)
④将长颈漏斗(或答玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生
注:实验步骤顺序写错,或者步骤②中加入盐酸,则不论其它步骤回答是否正确,小题(1)均不给分。
(2)使样品在反应时能保持在烧杯底适当的位置(或答避免反应时样品漂浮)
4.
| 实验方法 | 实验过程中所发生 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | H2SO4+Zn→ZnSO4+H2↑ H2+CuO | ①②③⑦ | 实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
| 2 | H2SO4+CuO→CuSO4+H2O | ①⑤⑧⑨ | 过滤后剩余固体的质量 |
| 3 | 2Cu+O2 | ①④⑥⑦⑧ | 实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也给分)
5.(1)第三步:向蒸馏烧瓶中放入几片碎瓷片缓慢加热
第四步:加热至65℃,收集馏出物
第五步:加热至78℃,收集馏出物
第六步:停止加热,待蒸馏烧瓶中的残液冷却后,向其中缓缓加入 18.4 mol/LH2SO4至过量,再加热至 118 ℃,收集馏出物。
(2)将乙酸中和生成乙酸钠,使乙酸乙酯在蒸