08届高考化学复习备考试题
化 学 试 卷(七)
第I卷(选择题 共44分)
相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 Cl—35.5 Cu—64
S—32 Mg—24 Ca—40 Mn—55 Fe—56 K—39 Ba—137
一、选择题(共22小题,每题只有1个正确答案,每小题2分
1.在水溶液中或在液态时导电能力都非常强的是 ( )
A.NaCl B.蔗糖 C.H2SO4 D.CaSO4
2.将一定量氯气通入溴化亚铁溶液中后,再加入四氯化碳振荡、静置,整个实验中,肯定可以观察到的现象是 ( )
A.四氯化碳层呈红棕色 B.水层呈黄色
C.四氯化碳层无色 D.在潮湿空气中形成白雾
3.下列反应不属于吸热反应的是 ( )
A.氢气还原氧化铜 B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
4.金属铜的提炼多从黄铜矿开始。黄铜矿在焙烧过程中主要反应之一的化学方程式为:
2CuFeS2 + O2 = Cu2S + 2FeS + SO2,下列说法不正确的是 ( )
A.O2只做氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1molO2参加反应,则有4mol电子转移
5.对于反应XeF4 + 2CH3CH = CH2→2CH3CH2CHF2 + Xe下列说法正确的是 ( )
A.XeF4被氧化 B.CH3CH = CH2是还原剂
C.该反应是非氧化还原反应 D.XeF4既是氧化剂又是还原剂
6.4℃时,25滴水为amL,则1滴水中含有的水分子数为 ( )
A.aNA/25 B.aNA/(25×18) C.aNA/(25×20) D.aNA/(1000×22.4)
7.下列叙述正确的是 ( )
①氯气的性质很活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
8.Na2O2晶体和Na2O晶体中阳离子和阴离子的个数比较,前者和后者的关系是 ( )
A.前者大 B.前者小 C.相等 D.不能确定
9.某气体的摩尔质量为Mg·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则![]() 表示的是 ( )
表示的是 ( )
A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量
C.1L该气体所含的分子数 D.以L为单位1mol该气体的质量
10.20℃时,将某盐R的溶液蒸发掉10g水,恢复到20℃,需在剩余溶液中加入6gR(无水)溶液即达饱和,若将原盐溶液蒸发掉30g水,则只需要加入1gR(无水)就可以达到20℃时的饱和溶液。则20℃时R的溶解度为 ( )
A.20g B.25g C.30g D.35g
11.由一种离子和两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以生成Cl2,下列关于混盐CaOCl2的有关判断不正确的是 ( )
A.该混盐的水溶液呈碱性
B.该混盐具有较强的氧化性
C.该混盐与H2SO4反应产生1 molCl2时转移NA个电子
D.该混盐中氯元素的化合价为-1价
12.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出 B.溶液pH值不变,有H2放出
C.溶液中Na+数目减少,有O2放出 D.溶液pH值不变,有O2放出
13.下列能够检验出KI中是否含有Br-的实验是 ( )
A.加入足量的新制氯水,溶液变色,则有Br-
B.加入酸性KMnO4溶液,观察溶液颜色是否褪色
C.加入少量的碘水,再加入CCl4,振荡,有机层有色则有Br-
D.加入足量的FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则有Br-
14.下列反应的离子方程式书写正确的是 ( )
A.碳酸氢镁溶液和过量NaOH溶液的反应:Mg2+ +2HCO32-+ 2OH-= MgCO3↓+2H2O
B.氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++ 2OH-+ 2H+ +SO42- = BaSO4↓+2H2O
C.亚硫酸钠和足量的稀硝酸混合:SO32-+ 2H+ = SO2↑+ H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ +2H+ + H2O2 = Fe3+ + 2H2O
15.NO3-+ Zn + OH- + H2O—NH3 + Zn(OH)42-配平后,离子方程式中H2O的化学计量数是
( )
A.2 B.4 C.6 D.8
16.VL浓度为0.5mol/L的盐酸,欲使其浓度增大一倍,可采取的措施是 ( )
A.通入标准状况下的HCl气体11.2VL
B.加入10mol/L的盐酸0.1VL,稀释至1.5VL
C.将溶液加热浓缩到0.5VL
D.加入VL1.5mol/L的盐酸混合均匀
17.在常温常压下,将盛满Cl2的一只度管倒立在水槽中,当日光照射一段时间至不再反应为止,试管中残留的气体约占整个试管体积的 ( )
A.1/2 B.1/3 C.2/3 D.1/4
18.已知热化学方程2KNO3(s) = 2KNO2(s) +O2(g);△H = +58kJ/mol;C(s) +O2(g) = CO2(g);
△H =-94kJ/mol。为提供分解1molKNO3所需能量理论上需燃烧碳 ( )
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
19.在一定条件下,RO3-与R-可发生反应:RO3-+5R- +6H+ = 3R2 + 3H2O,下列关于R元素的叙述中,正确的是 ( )
A.R位于周期表中VA族 B.R的气态氢化物的水溶液是强酸
C.RO3-中的R只能被还原 D.R2在常温常压下一定是气体
20.向等体积的FeBr2、KI、Na2S溶液中分别通入Cl2,充分反应后,若耗用的Cl2的体积相同(均在相同条件下反应),则FeBr2、KI、Na2S三种溶液的物质的量浓度之比为( )
A.3:2:1 B.3:1:2 C.3:6:2 D.2:6:3
21.把aL含硫酸铵和硝酸铵的混合溶液分成两等份,一份需用bmol烧碱刚好把氨全部赶出,另一份与氯化钡反应时,消耗BaCl2 c mol,由此可知原溶液中NO3-的物质量浓度是( )
A.(b-2c) /a mol·L-1 B.(2b-c) /a mol·L-1
C.(2b-2c) /a mol·L-1 D.(2b-4c) /a mol·L-1
22.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下其充分反应后的固体,经测定Na2O2无剩余,则最后和固体的物质的量为 ( )
A.1~4 mol之间 B.1~2mol之间
C.2~4 mol之间 D.大于4mol
第Ⅱ卷(非选择题 共56分)
二、填空题(本题包括4小题,共20分)
23.在反应3BrF3 + 5H2O = HbrO3 + Br2 + 9HF + O2中,当有3mol水参加反应时,由BrF3还原的BrF3为 mol;总共转移的电子数为 mol。
24.配平面反应方程式并用单线桥标出电子转移的方向和数目
![]()
![]()
![]()
![]()
![]()
![]()
![]() MnO4- + H2O2
+ H+
Mn2+ + O2
+ H2O
MnO4- + H2O2
+ H+
Mn2+ + O2
+ H2O
25.在标准状况下,用圆底烧瓶收集氨气,当混合气体的平均式量为19时停止收集,并将其倒扣在水槽中,假设溶液无损失,YC得到溶液的密度为ρg·cm-3。则所得溶液的物质的量浓度为 。
26.某溶液中含有SO42-、CO32-、OH-、Cl-,若只允许取一次该溶液而把四种离子分别检验出来,则应该采取什么样的措施(能写出离子方程式的,写出每检验出一种离子的离子反应方程式)
(1)先检验 ;加入 试剂(或溶液),离子方程式
(2)然后检验 ;加入 试剂(或溶液),离子方程式
(3)再检验 ;加入 试剂(或溶液),离子方程式
(4)最后检验 ;加入 试剂(或溶液),离子方程式
三、推断题(共14分)
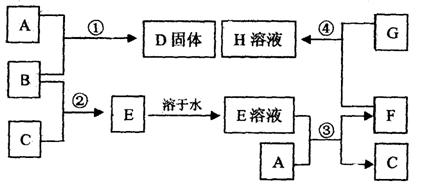
27.室温下,单质A、B、C、D分别为固体、液体、无色气体、黄绿色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的。请回答:
|
(1)(请填化学式)A是 B是
C是 D是 H是
(2)反应③的离子方程式: 。
(3)反应④的离子方程式: 。
四、实验题(共13分)
28.实验室配制500mL 0.500mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1——2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2——3次,洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
⑥检验容量瓶是否漏水
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)本实验用到的基本实验仪器有 。
|
对所配制溶液浓度将有何影响?
(填“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,对所配制溶液浓度将有何影响:
没有进行操作步骤④ ;
加蒸馏水时不慎超过了刻度线 。
(5)若实验过程中出现如下情况应如何处理?
①加蒸馏水时不慎超过了刻度线 。
②向容量瓶中转移液体时(实验步骤②)不慎有液滴掉在容量瓶外面 。
五、计算题(共9分)
29.已知Cl2通入浓氨水中会发生如下反应:3Cl2 + 8NH3 = 6NH4Cl + N2。今有体积为1.12L,质量为3.335g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672L[其中Cl2和N2各占50%(体积分数)]。(气体体积均为标准状况下测定)。
(1)经计算,被氧化的NH3的质量为 (不用写计算过程)
(2)下面是三位学生从不同角度解这道题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
| 学生编号 | 所列第一步算式 | 未知数X表示的意义 |
| 甲 | (3-1):2 = (1.12-0.67)/22.4:X | |
| 乙 | 3:(X-0.672/2) = 1:[0.672/2-(1.12-X)] | |
| 丙 | 71X +28 (1-X) = (3.335/1.12)×22.4 |
参考答案
一、选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| A | B | C | D | B | B | C | C | B | B | D |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| C | D | B | C | B | A | B | B | D | D | A |
![]() 二、23. 2/5; 3.6 (各2分)
二、23. 2/5; 3.6 (各2分)
| ||||||
| ||||||
| ||||||
![]()
|
|
|
25.1/22.4 mol·L-1 (3分)
26.(1)OH-,酚酞 (2)CO32-, HNO3, CO32- + 2H+ = CO2↑+ H2O
(3)SO42-, Ba(NO3)2 Ba2+ + SO42- = BaSO4↓
(4)Cl-,AgNO3 Cl- + Ag+ = AgCl↓ (各1分)
三、27.(1)A是Fe B是Br2 C是H2 D是FeBr3 H是FeCl3、Br2(只答FeCl3不给分)
(2)反应③的离子方程式:Fe + 2H+ = Fe2+ + H2↑
(3)反应④的离子方程式:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- (方程式各2分,其它各2分)
四、28.(1)步骤是⑥①②④③⑤ (2分)
(2)500mL容量瓶、天平、烧杯、量筒、玻璃棒、胶头滴管(6分)
(3)偏高 (4)偏低, 偏低 (5)①重新配制 ②重新配制 (5分)
五、29.(1)0.34g (3分)
(2)甲:x表示 被氧化氨的物质的量 (2分)
乙:x表示 反应前Cl2的体积 (2分)
丙:反应前混合物中Cl2所占的体积分数(或物质的量分数) (2分)