2006年韶关市普通高等学校招生考试模拟测试
化 学
2006.4
本试卷分选择题和非选择题两部分。共8页,满分150分。考试用时120分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号填写在答题卡上。用2B铅笔将答题卡上相应的信息点涂黑。
2.选择题每小题选出答案后,用2B铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cl:35.5
Na:23 Fe:56 Cu:64
第一部分 选择题(共67分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同素异形体 B.①②③互为同位素
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
2.下列实验中用错试剂的是:
A.用稀盐酸清洗做焰色反应的镍铬丝; B.用酒精萃取碘水中的碘;
C.用稀硝酸洗去残留在试管壁上的铜; D.用碱石灰吸收氨气中的水蒸气
3.设NA为阿伏加德罗常数,下列叙述正确的是
A.在100 mL 0.5 mol / L CH3COOH溶液中CH3COOH分子数等于0.05 NA;
B.标准状况下,11.2 L CH4中所含电子数总和为5 NA;
C.在100 mL pH=1的稀硫酸中,水合氢离子数为0.1 NA;
D.15.6 g Na2O2跟过量CO2反应时,转移电子数为0.4 NA。
4.某共价化合物含碳、氢、氮三种元素,分子内有四个氮原子,且四个氮原子排列成内空的四面体(如白磷结构),每两个氮原子间都有一个碳原子。已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为
A.CH8N4 B.C4H8N4 C.C6H10N4 D.C6H12N4
5.下列叙述正确的是
A.任何晶体中,若含有阳离子也一定含有阴离子
B.离子晶体中只含有离子键
C.原子晶体中含有共价键
D.分子晶体中只存在分子间作用力,不含有其它化学键
6.下列反应的离子方程式错误的是
A.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O == AlO2- + 4NH4+ + 2H2O
B.用氨水吸收过量的二氧化硫 NH3·H2O + SO2 == NH4+ + HSO3-
C.碳酸钠溶液中加入过量的苯酚 C6H5OH + CO32- —→ C6H5O- + HCO3-
 D.次氯酸钙溶液中通入过量的二氧化碳 ClO- + CO2 + H2O
== HCO3- + HClO
D.次氯酸钙溶液中通入过量的二氧化碳 ClO- + CO2 + H2O
== HCO3- + HClO
7.600℃时,在一密闭容器中,将二氧化硫和氧气混合,
一定条件下,发生如下反应:
2SO2(g)+O2(g) ![]() 2SO3(g) ;ΔH <0,
2SO3(g) ;ΔH <0,
反应过程中SO2、O2、SO3物质的量变化如右图,
据图判断,10 min到15 min的曲线变化原因可能是:
①加了催化剂 ②缩小容器体积
③降低温度 ④增加SO3的物质的量
A.② B.①② C.①②③ D.①②③④
8.下列5个有机化合物中,能够发生酯化、加成和氧化3种反应类型的是
① CH2=CHCOOH ② CH2=CHCOOCH3 ③ CH2=CHCH2OH
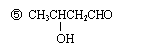 ④ CH3CH2CH2OH
④ CH3CH2CH2OH
A. ①③④ B. ②④⑤ C. ①③⑤ D. ①②⑤
9.标准状况下H2S和O2混合气体100 mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10 mL,该10 mL气体可能是
A.H2S、SO2 B.O2 C.H2S D.SO3
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10.下列物质的分离、提纯和鉴别的方法中(必要时可加热),可行的是
A.以AgNO3溶液和稀盐酸检验溶液中是否含有Cl-
B.用升华法分离碘和氯化铵的混合物
C.以粗铜为阴极,精铜为阳极,CuSO4溶液为电解液,精炼铜
D.用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+
11.短周期元素X和Y可以相互形成化合物X2Y,那么X和Y所在族的族序数之差可能是
A.1 B.3 C.4 D.5
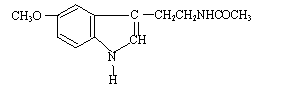 12.脑白金,其有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
12.脑白金,其有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
A.它属于芳香烃
B.它属于高分子化合物
C.分子式为C13N2H16O2
D.在一定条件下可以发生加成反应
13.目前人们正在研究一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式如下:2Na + xS![]() Na2Sx,以下说法正确的是:
Na2Sx,以下说法正确的是:
A.放电时钠作正极,硫作负极;
B.放电时钠极发生还原反应
C.充电时,阳极发生的反应为:Sx2--2e = x S
D.充电时钠极与外电源的正极相连,硫与外电源的负极相连
14.液氯是一种重要的化工原料,在运输和储存中应注意安全。去年3月29 日,京沪高速公路淮安段发生一起严重交通事故,使槽罐车中32 t液氯快速泄漏,造成人员伤亡、大片农田被毁的严重事故。对于在事故发生时的下列各种应急处理,你认为正确的是
A.附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向逃逸或向避风的沟塘低洼处转移
B.要快速地将翻落的氯槽罐安全起吊移至水池,进行碱液稀释中和
C.液氯的流淌速度很慢,居民不必惊慌,可以放心地撤退到家中,关紧门窗
D.检修或现场抢救时,如果没有防毒面具,可以佩戴用浓的烧碱溶液浸泡过的湿口罩
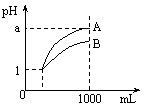 15.室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
15.室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.稀释后,a可能大于4。
16.短周期元素x、y、z在周期表中的位置关系如右图所示:
| x | ||
| y | ||
| z |
以下的叙述中正确的是
A.z一定是活泼金属元素
B.x的最高氧化物的水化物是一种强酸
C.1 mol y的单质跟足量水反应时,发生转移的电子有2 mol
D.由z单质形成的晶体属于分子晶体
17.室温时某溶液的pH值为1,该溶液中可能大量共存的离子组是
A.Zn2+、Cl-、Ba2+、NO3- B.Cu2+、NO3-、Al3+、SO42-
C.K+、SO42-、Na+、AlO2- D.Na+、NO3-、K+、CO32-
18.对于反应2SO2 + O2
![]() 2SO3,下列判断错误的是
2SO3,下列判断错误的是
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.单位时间内每生成1 mol SO2,同时消耗1.5 mol O2,则反应必逆向进行
19.下列说法或表示法正确的是
A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)—→C(金刚石);△H= +119 kJ / mol ”可知,金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O;△H=-57.3 kJ / mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H = +285.8 kJ / mol
第二部分 非选择题(共83分)
三、(本题包括2小题,共23分)
20.(6分)请从下列a~g仪器中选择适当的仪器填空(填编号)。
(1) 开始时液面在a mL处,继续添加液体至液面在b mL处,则所加液体体积为(a-b)mL的是________________。
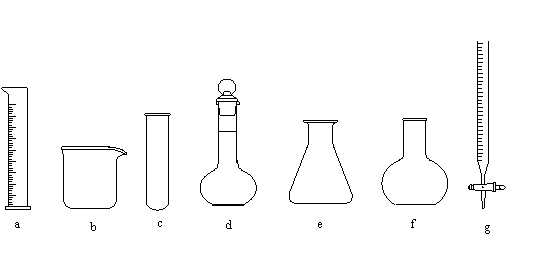 |
(2) 仪器上标明了使用温度的是________________。
(3) 用8.2 mL的浓盐酸配制一定物质的量浓度的稀盐酸,不可缺少的仪器是________________。
21.(17分)硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)_______________________________________________。
(3)为了吸收反应产生的尾气,设计了下列尾气的处理装置,其中合理的是_______________(填装置序号),选择的吸收液是_________________(填序号)。
供选择的装置:
 |
供选择的吸收液:
A 、浓H2SO4 B、H2O C、NaOH D、饱和食盐水
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(4)用离子方程式表示速率明显加快的原理_______________________________________________。Fe2(SO4)3的作用是___________________________。
(5)得到的混合液用______________调节pH =2~4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(6)请根据以上内容,对这两个实验方案进行评价,填下表:
|
| 实 验 一 | 实 验 二 |
| 主要优 点 | ||
| 主要缺 点 |
四、(本题包括2小题,共22分)
22.(12分)B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:
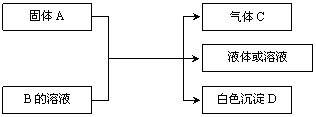 |
回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为____________________________________________________。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
① 若C为能使澄清石灰水变浑浊的无色无味气体,该反应的离子方程式为____________________________________________________。
② 若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为__________。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________。
23.( 10分)将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:
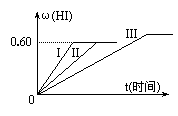 I2(g)+H2(g)
I2(g)+H2(g)![]() 2HI(g);△H<0,
2HI(g);△H<0,
并达到平衡,HI的体积分数ω(HI)随时间变化如图
曲线(II)所示:
(1)达平衡时,I2(g)的物质的量浓度为______________。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是__________(填入下列条件的序号。下同),乙条件可能是___________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是___________。
五、(本题包括2小题,共18分)
24.(8分)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的化学式为_____________。
已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
(2)A与氢气加成生成2—甲基戊烷,则A的可能结构有___________种。
(3)B能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则B的结构简式为:
________________________
(4)C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:____________________________
25.(10分)已知:
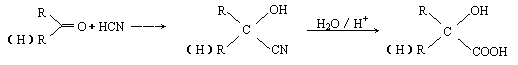
有机玻璃可按下列路线合成:
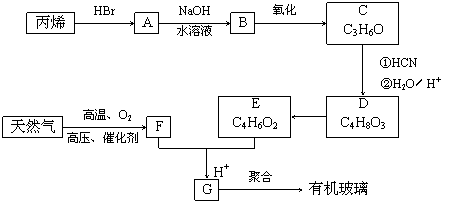 |
 |
其中D的结构简式为: ,G的化学式为C5H8O2 ,F亦可由水煤气在高温、高压、催化剂下合成。
试写出:
(1)天然气主要成分的电子式为______________,B的结构简式为____________________。
(2)E+F → G的反应方程式为___________________________________________________。
(3)“丙稀 → A”和“D → E”的反应类型分别属于________________、________________。
(4)写出分子中同时含有—OH和—COOH的D的同分异构体的结构简式
_____________________________________________________________
六、(本题包括2小题,共20分。)
26.(8分)下图为某市售盐酸试剂瓶标签上的部分数据,问:
(1)该盐酸的物质的量浓度为多少?
 |
(2)取该盐酸25.4 mL与2.00 mol·L-1的氢氧化钠
溶液100 mL混合,再将混合液稀释到1.00 L,
此时溶液的pH约为多少?
27.(12分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x,研成粉末后,全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为 。(写出所有可能的情况)
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) 。
(3)当x=50%,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生0.672 L气体,求a、b的值。
2006年韶关市普通高等学校招生考试模拟测试
化学试题参考答案及评分标准
第一部分 选择题(共67分)
一.(本题包括9小题,每题3分,共27分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | B | D | C | A | B | C | C |
二.(本题包括10小题,每题4分,共40分)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | D | AD | CD | C | B | C | CD | AB | AD | C |
第二部分 非选择题(共83分)
三、(本题包括2小题,共23分)
20.(6分)(1) g (2)a d g ③(3)a b d 或b d g(每空2分)
21.(17分)
(1)氧化剂(2分)
(2)Cu+2HNO3+H2SO4=CuSO4+2 NO2↑+2H2O
或3Cu+2HNO3 +3H2SO4= 3CuSO4+2 NO↑+4H2O (2分)
(3)B、C(2分); C (2分)
(4)2Fe3+ + Cu = Cu2++ 2Fe2+ 、4 Fe2+ + O2 + 4H+ = 4 Fe3+ + 2H2O (各1分,共2分)
催化剂(1分)
(5)CuCO3或CuO (2分,任写一个得满分)
(6)(每空1分,共4分)
| 实验一 | 实验二 | |
| 主 要 优 点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
| 主 要 缺 点 | (1)可能有有毒气体排放;(2)硝酸没有转化为产品,不符合绿色化学原理 | (1)操作步骤较多 (2)硫酸铜晶体可能不太纯净 |
四、(本题包括2小题,共22分)
22.(12分)
(1)NH4HSO4(2分) NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3↑+2H2O+BaSO4↓(3分)
(2)① 3CO32- + 2Al3+ + 6H2O = 3CO2↑+ 2Al(OH)3↓
或 3HCO3-+ Al3+ == 3CO2↑+ Al(OH)3↓ (3分)
② Al2(SO4)3 (2分)
(3)CaC2 (2分)
23.(10分)
(1)0.05 mol·L-1 (3分)
(2) ③⑤(2分),②(2分)
(3)4a + c = 2b (3分)
五、(本题包括2小题,共18分)
![]()
 24.(8分,每空2分)
24.(8分,每空2分)
(1) C6H12 ; (2)4 ; (3) ; (4)
 25.(10分)
25.(10分)
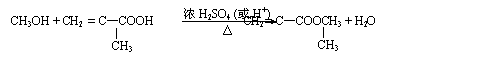
![]() (1)
;
(各1分,共2分)
(1)
;
(各1分,共2分)
(2) (2分)
(3)加成反应、 消去反应 (各1分,共2分)
![]() (4)
、
、
、
。
(4)
、
、
、
。
(各1分,共4分)
六、(本题包括2小题,共20分。)
26.(8分)
(1) ![]()
(2) n(HCl)=11.8 mol·L-1×0.0254 L=0.300 mol
n(NaOH)=2.00 mol·L-1×0.100 L=0.200 mol
剩余H+的物质的量为0.300 mol-0.200 mol=0.100 mol
稀释后H+的物质的量浓度为c(H+)=![]() =0.100 mol·L-1
=0.100 mol·L-1
所以pH=1
27.(12分)
(1) Fe2+ 或Fe2+、Cu2+ (各2分,共4分)
(2) 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 3Fe+8HNO3 = 3Fe(NO3)2 +2NO↑+4H2O
a x ![]() a x
a (1-x)
a x
a (1-x) ![]() (1-x)
(1-x)
故消耗HNO3总量n(HNO3)=![]() +
+![]() =
=![]()
所以![]() <b≤
<b≤![]() (4分)
(4分)
(3)根据电子守恒:0.5a×2+0.25a×3+0.25a×2=![]() ×3
×3
解得a=0.04
又知 3Cu ∽ 8HNO3 3Fe ∽ 8HNO3(生成Fe2+)
0.02mol ![]() mol 0.01mol
mol 0.01mol ![]() mol
mol
Fe ∽ 4HNO3(生成Fe3+)
0.01mol 0.04mol
b=![]() +0.04+
+0.04+![]() =0.12 (4分)
=0.12 (4分)