2005/2006学年度盐城市高三第—次调研考试
化 学 试 题
注意:请将选择题答案涂在答题卡上,其余答案写在答题纸上
第Ⅰ卷 (选择题 共74分)
可能用到的相对原于质量:H1 Li7 C12 N14 016 Na23 P31 C1 35.5 K 39 Cu64 Ag 108
一、选择题(本题包括8小题,每题4分,共32分。每小题只有一个选项符合题意)
1.“卡西尼,’号探测器传回有关土卫五的数据信息表明,固态氨占土卫五总质量的四分之一, 所以土卫五也称为“氨星”。下列有关氨的说法不正确的是
![]() A.氨是由极性键构成的非极性分子 B.固态氨中,分子之间存在氢键
A.氨是由极性键构成的非极性分子 B.固态氨中,分子之间存在氢键
C.固态氨属于分子晶体 D.氨分子的比例模型为
2.生产生活中有关做法或说法没有科学道理的是
A.在雾天夜间行驶的汽车需打开钠光灯
B.催熟水果可用能释放出乙烯的乙烯利稀溶液浸泡
C.为防止煤矿瓦斯爆炸,在矿井中加石灰吸收瓦斯气
D.为增强洗衣粉对血渍、奶渍等蛋白质污物的去污能力,可在洗衣粉中加入蛋白酶
3.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维 ![]()
下列说法正确的是
A.羊毛与聚酯纤维的化学成分相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇 D.由单体合成聚酯纤维的反应属加聚反应
4.设NA表示阿伏加德罗常数,下列有关说法正确的是
A.分解H2O2制O2,每生成1mol O2转移,4NA个电子
B.25℃时1LpH=7的醋酸与醋酸钠的混合溶液中,一定有10-7NA个醋酸分子被电离
C.标准状况下,22gC3H8与N2O混合气体所占体积约为11.2L
D.用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2溶液,当有0.2NA个电子转移时,阴极析出6.4g金属
5.下列说法正确的是
A.丁达尔现象实验可鉴别蛋白质溶液和淀粉溶液 B.少量白磷需保存在水中
C.肥皂去油污与汽油去油污原理相同 D.相同浓度的甘氨酸与乙酸的pH相同
6.最近广东北江发生严重的水体镉污染事件,专家确定用1200吨的聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
A.10848Cd 核素中中子数为60 B.含镉废电池应进行回收处理
C.PFS中铁显十2价
D.实验室由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
7.达菲(Tamiflu)被认为是目前世界上公认的能够治疗人禽流感病的唯一有效的药物,它是由我国特有中药材八角的提取物——莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:
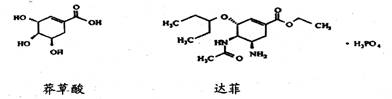
下列判断正确的是
A.它们互为同系物 B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在 D.莽草酸的分子式为C7H10O5
![]() 8.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
8.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B. N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1m01N4气体转变为N2将吸收882kJ热量
二、选择题(本题包括10小题,第9~16小题每小题4分,第17、18小题每小题5分,共42分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列离子方程式书写正确的是
A. 铜溶于氯化铁浓溶液中:Cu+Fe3+=Cu2++Fe2+
B. NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH4++OH-=NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3+2H+=2Ag++CO2↑+H2O
D.Ba(HCO3)2溶液中通入过量氨气:Ba2++ HCO3-+NH3=BaCO3↓+NH 4+
10.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现了A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I—等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A.All4与ⅡA族元素性质相似
B.A113与卤素性质类似
C.A113在气相中与HI反应的方程式可表示为:A113+HI=HAl13I
D.A113超原子中A1原子间是通过离子键结合的
11.某无色溶液中,若加入溴水,溴水褪色,若加入金属铝,铝溶解并产生大量氢气,则该溶液中可能大量存在的离子组是
A.Na+、OH—、S 2—、ClO— B.H+、Na+、Fe2+、NO3—
C.K+、Ba2+、OH—、SO32— D.Na+、K+、Ba2+、OH-
12.某短周期元素的最高价氧化物所对应的水化物的化学式为HxROY,气态氢化物的化学式为HzR(或RHZ)。已知1molHxROY比lmolHzR质量多64g。下列说法不正确的是
A.2Y—X+Z=8 B.Y=4
C.R一定是硫元素 D.R一定处于第三周期
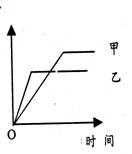
13.可用右侧示意图象表示的是
| 反应 | 纵坐标 | 甲 |
| |
| A | 等质量钾、钠分别与水反应 | H 2质量 | 钠 | |
| B | 相同质量氨,在同一容器中 2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| C | 体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2m01S02与lm0102,在相同温度下 2S02+02 | S03物质的量 | 10atm | 2atm |
14.2005年2月14日新华社报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,。常见镍氢电池的某极是储氢合金LaNi5 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
![]()
下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.充电时阳极周围c(OH—)增大
D.放电时负极反应:
15.近年来研制的NF3气体可运用声氟化氢——氟化氚高能化学激光器中的氟源,也可作为火 箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2=NF3+3NH4F。
下列说法不正确的是
A. NF3的形成过程用电子式可表示为:![]()
B. NF3的氧化性大于F2
C. NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价
16.有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1mol/LNaOH溶液、0.1mol/L盐酸和0.1mol/LNaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。四位学生的鉴别结果如下:
| 甲 | 1号为0.1mol/L盐酸 | 4号为0.1mol/LNaCl溶液 | 老师评价:四位学 生都及格,但是没 有一个得满分 |
| 乙 | 1号为0.1mol/LNaOH溶液 | 3号为0.1mol/L盐酸 | |
| 丙 | 1号为1%酚酞 | 2号为0.1mol/L盐酸 | |
| 丁 | 4号为0.1mol/L盐酸 | 2号为NaOH溶液 |
正确的结论是
A.1号为1%酚酞 B.2号为0.1mol/LNaCl溶液
C. 0.1mol/LNaOH溶液 D. 0.1mol/L盐酸
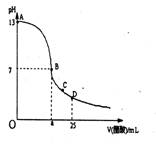 17.在25mL0.mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓
17.在25mL0.mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓
度关系比较正确的
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
B.在B点,a>12.5,且有c(Na+)==c(CH3COO—)=c(OH—)==c(H+)
C.在C点:c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
D。在D点:c(CH3COO—)十c(CH3COOH)==2c(Na+)
18.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
aHClO3===bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O==12H++10Cl—+2IO3—
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3 ====15O2↑+8C12↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e—
第Ⅱ卷 (非选择题 共76分)
三、(本题包括2小题,共22分)
19.(10分),请按要求填空:
(1)下列实验操作或实验叙述正确的是 (填序号A、B、C、D)
①配制氯化亚铁溶液时,需加少量盐酸及铁粉;
②用10mL量筒量取5.80mL盐酸;
③用稀醋酸除去热水瓶内的水垢;
④检验卤代烃中卤素时,直接将卤代烃加入硝酸酸化的硝酸银溶液中
⑤金属钠着火可用干燥的细沙扑灭;
⑥用排水法收集氢气时,不需要检验纯度,可直接点燃;
⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液,再滴入酚酞试液;
⑧可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸。
A.①②③④⑥⑦⑧ B.①④⑥ C.⑤⑥⑦ D.①③⑤⑦
(2)测定有机化合物中碳和氢组成常用燃烧分析法,下图是德国化学家李比希测定烃类有机 物组成的装置,氧化铜做催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和高氯酸镁[Mg(C1O4)2]的吸收管分别吸收CO2和H2O。
试回答下列问题:
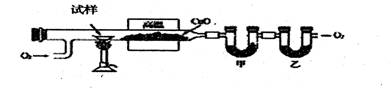
①甲装置中盛放的是 ,甲、乙中的吸收剂能否填倒?说明理由: 。
②实验开始时,要先通入氧气一会儿,然后再加热。为什么? ③若测得甲装置增重ag,乙装置增重bg,试求出烃中碳、氢原子个数比为: ④若已知试样是纯净物,某次测定时,测出碳、氢原子个数比为C:H=11:23,能否确 定其为何种烃? (填:能或不能);若能,写出其分子式 (若不能,此空不必回答)。
20.(12分)亚硝酰氯(C1NO)是有机合成中的重要试剂,可由NO与C12在通常条件下反应得到, 另外硝酰氯可由二氧化氮与氯气作用得到。某研究性学习小组拟在通风橱中制取亚硝酰氯,先查得其如下资料:
| 英文名称 | nitrosylchloride nitrogenoxychloride | 别名 | 氯化亚硝酰;氧氯化氮 | |||
| 分子式 | C1NO | 外观与性状 | 红褐色液体或黄色气体,具有刺鼻恶臭味,遇水和潮气分解成氮的氧化物和氯化氢。 | |||
| 熔点 | —64.5℃沸点:-5.5℃ | 溶解性 | 溶于浓硫酸 | |||
| 危险标记 | 有毒气体,有机剧毒品 | 主要用途 | 用于合成清洁剂、触媒及中间体 | |||
后他们拟定了如下合成装置示意图:
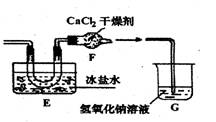
![]()
|
|
|
|


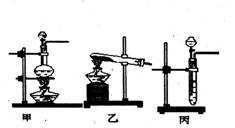
试回答下列问题:
(1)制备NO最好选用的装置是 (选填:甲、乙、丙,下同),制备C12应选用
的装置是 。
(2)实验室制取氯气的化学方程式为 。
(3)无水氯化钙的作用是: 。
(4)写出亚硝酰氯水解的化学方程式: 。
(5)指导老师认为装置G不能有效除去有毒气体,写出你的见解和改进措施。
。
四、(本题包括2小题,共18分)
21.(8分)无机过氧化合物的科学研究开始于18世纪初,人们相继制得了过氧化钡、过氧化钠、过氧化钾、过氧化氢等,目前无机过氧化合物逐渐成为无机化学的一个分支,其中过氧化氢是用途最广的过氧化物。试回答下列问题。
(1)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(2)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程 式: 。
(3)与过氧化氢具有相同电子总数且属于非极性性分子的有 、 (举两例, 写化学式)。
(4)纯的过氧化氢常用作火箭燃料的氧化剂,已知0.4m01液态肼(N2H4)与足量的液态过氧化氢反应,生成N2和H2O(g),放出256.6kJ的热量。.则该反应的热化学方程式为
22.(1.0分)已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸干并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成三它们有如下框图关系:
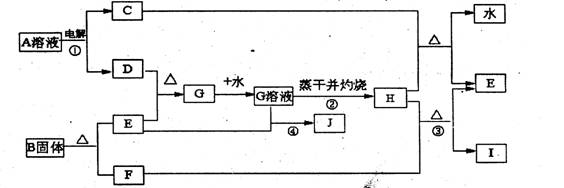
试回答下列问题
(1)反应①阳极的电极反应式 。
(2)反应③的化学方程式 。
(3)反应④的审子方程式 。
(4)反应②蒸发至于并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
。
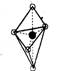 (5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
写出B的化学式 。
五、(本题包括2小题,共18分)
23.(10分)试完成(1)、(2)两小题。
(1)今有相对分子质量为M的有机物,燃烧后只生成二氧化碳和水。
①若有机物是M=72的烃,请写出所有可能的结构简式: ; ; ; ②若M=58,且lmol该有机物与足量的银氨溶液作用,可析出4molAg,则其结构简式 为 ;
③若A是分子式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为: 。
(2),奥美拉唑(Omepraz01e)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。·奥美拉唑的合成路线如下(Me表示甲基)
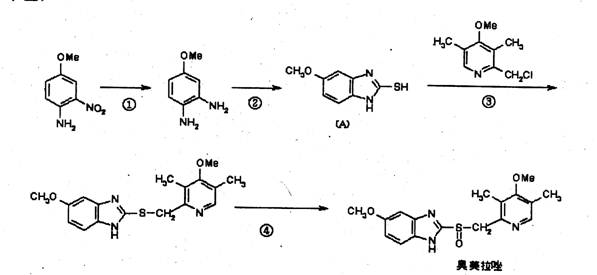
试回答下列
(a)写出反应类型① 反应,③ 反应,④ 反应。
(b)反应②是与一种无机小分子反应(在氢氧化钾作用下),一分子与一分子反应时脱去一分子硫化氢得到(A)的,这种无机小分子化学式为:
(c)为使最终产品尽量少含杂质,反应过程中不产生污染物,你认为反应④中选用一种理想的无机试剂应是 (填化学式)。
24.(8分)2005年诺贝尔化学奖由法国科学家YvesChauvin、美国科学家RobertH.Orubbs、 RichardR.Schrock共同获得。以表彰他们在烯烃复分解反应方面研究与应用所作出的贡献。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。可表示为:
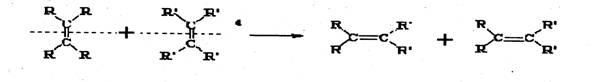
|
![]() 又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
有机物R是烃的含氧衍生物(分子式为:C9H14O6),常用作纤维的增塑剂以及化妆晶等,F也可由油脂水解得到,有机物R的合成路线如下:
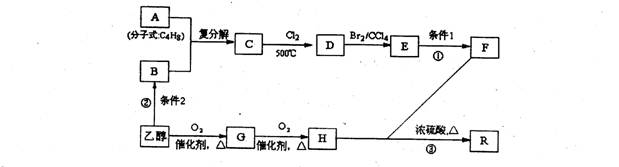 试回答下列问题
试回答下列问题
(1)写出反应①、②的反应条件:条件1 ;条件2 。
(2)写出结构简式,A: ;E: 。
(3)写出反应③的化学方程式: 。
六、(本题包括2小题,共18分)
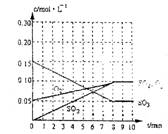
 25. (8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
25. (8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
(1)0min~4min内生成O2平均速率v(O2)= mol/L·min
(2)达到平衡时c(O2)=c(SO2),则a= mol/L,在下列
坐标系中作出0min~8min及之后SO2、O2、SO3浓度
随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol/L的是
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
26.(10分)材料M由X、Y两种元素组成,已知M的化学组成为XY8,X为碱金属元素。为进一步确定其成分,先取一定量的M在足量的纯氧中充分灼烧,产生了无色略带酸味的气体A和过氧化物B(此条件下不考虑A与B反应),且A能使澄清石灰水变浑浊。另取1.17gB加入水中能完全溶解,再将其定容为500mL,取出25.00mL加入锥形瓶中,用0.1150mol/L盐酸滴定,当滴入10.00mL盐酸时,经测定溶液的pH=12。
(1)通过计算和推理确定组成:A是 (填化学式,下同),B是
M是
(2)若取xgM(甲、乙两种元素化合价均为0),加热使其完全溶于浓硝酸,假定浓硝酸还原产物只有NO和NO2且两者的物质的量相同,试通过计算求出反应中消耗硝酸的物质的量y与材料M的质量x的函数关系表达式。
2005/2006学年度盐城市高三第—次调研考试
化学试题参考答案与评分标准
一、二选择题(74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 | A | C | B | C | B | C | D | B |
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | D | C | A | BD | B | A | CD | BD |
三、(22分)
19.(10分)(1)(4分)D(2)每空均为1分,共6分. ①高氯酸镁或写Mg(C1O4)2不能,因氢氧化钠同时能吸收CO2和H2O,无法确定生成的水和CO2的质量。②将装置中的空气排尽,否则因空气中含有二氧化碳和水蒸气,影响测定结果的准确性③9b:44a④(因n(H)/n(C)=23:11>2,只能是烷烃);C22H46
20.(12分)每空均2分。
|
⑵ MnO2十4HCl(浓)==== MnCl2+2H2O+C12↑
(3)防止水蒸气进入U型管使CNO分解
(4)2C1NO十H2O===2HCl十NO↑+NO2↑(或写作:2C1NO +H2O===2HCl + N2O3)
 {5)氢氧化钠溶液只能吸收氯气和C1NO不能吸收NO;在F、G之间加上如图所示的装置 (改进措施只要答出在合适的装置中同时通氧气再用氢氧化钠吸收,不一定要作图,其它合理答案均参照给分。)
{5)氢氧化钠溶液只能吸收氯气和C1NO不能吸收NO;在F、G之间加上如图所示的装置 (改进措施只要答出在合适的装置中同时通氧气再用氢氧化钠吸收,不一定要作图,其它合理答案均参照给分。)
四、(共18分)
21. (8分)每空均2分。(1)
(2)H2O2+2H++2Fe2+==2Fe2++2H2O
(3)SiH4,F2,C2H6,Ar(每写对一个给1分)
(4)N2H4(1)十2H2O2(1)==N2(g)+4H2O(g); △H==-641.5kJ/mol
22.(10分)每空均2分。
(1)2Cl--2e-==C12↑
|
(2)Fe2O3+3CO====2Fe+3CO2
(3)2Fe3++Fe==3Fe2+
|
得不到无水FeCl3,(答出要点,但未写出方程式的给1分)
(5)Fe(CO)5或者FeC5O5
五、(共18分)
23. (10分)每空均1分。
(1) ①CH3CH2CH2 CH2CH3; CH3CH(CH3) CH2CH3; CH3C(CH3)2 CH3
②OHC-CHO
③C7H12O4
(2)a:还原(或氧化还原反应);取代;氧化(或氧化还原反应) b:CS2 C:H2O
24.(8分)问题(1)每空1分,其余每空2分.
(1)氢氧化钠水溶液,加热;浓硫酸,170℃(加热)
(2) CH3CH=CHCH3;CH2C1CHBrH2Br
|
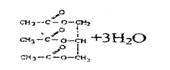
|
(只要有机结构简式正确,未配平或水未写不扣分)
六、(共13分)
25.(8分)每问均2分。
(1) 0.025mol/L. min
(2)a=0.05 mol/L 图象如右
(3) BD
26.(1) CO2;Na2O2; NaC8
(2) 解:由氮守恒,消耗的硝酸:n(HNO3)=n(NaNO3)+n(NO)+n(NO2)
由得失电子守恒 33n(C8Na)=3n(NO)+n(NO2)
由题意知:n(NO)== n(NO2)
故有:Y=x/119+2n(NO)……①
3x/119=4n(NO)……②
由①②解得Y=35.5X/238=0.147x (说明:过程正确,结果不正确给2分,其它解法只要结果正确参照给分)
 乙
乙