专题(一) 氧化还原反应
学习目标:从氧化还原反应的角度来分析化学反应的类型;判断氧化剂和还原剂,标出电子转移的方向和数目;依据有关规律比较氧化性还有性的相对强弱,判断氧化还原反应的可能性及产物;有时还需要应用化学键理论判断是否属于氧化还原反应;电子守恒原理的应用;根据化合价升降总数守恒配平化学反应方程式。
典型例题:
例1.重铬酸铵[(NH4)2Cr2O7]受热分解的反应为氧化还原反应。下列对重铬酸铵受热分解产物的判断符合实际的是( )
A. CrO3+ NH3+ H2O B.Cr2O3+ NH3+ H2O
C. CrO3+N2+H2O D.Cr2O3+ N2+ H2O
例2.9.8gFe、Mg混合粉末溶解在一定量的某浓度的稀硝酸中,当金属粉末完全溶解后,收集到0.2mol的NO气体(设稀硝酸的还原产物只有NO),在反应后的溶液中加入足量的KOH溶液,可生成氢氧化物沉淀的质量为(不考虑氢氧化亚铁和氧气反应)( )
A.18g B.20g C.22g D.24g
例3. 某类硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体:
(1)某种硝酸盐受热分解后,若产生NO2和O2的物质的量之比为6︰1,则金属元素的价态在反应过程中___ _____(填“升高”、“降低”、“不变”)
(2) 现取mg Cu(NO3)2无水晶体,强热使其分解,得到NO2、O2和ng固体。将气体用水充分吸收后,结果还有气体剩余,同时得到100mL溶液。则:残留固体成分可能是_____________ _______________(用化学式表示);所得溶液的物质的量浓度是__________________(用只含m的代数式表示);
(3)(2)中m = 3.76,n = 1.52。试通过计算确定残留固体的成分及其质量
课堂练习
1. 将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cl、Cr元素组成。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可过量的KI中氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为( )
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
2.在一定条件下,氯酸钾与碘发往反应KclO3+I2=2KIO3+Cl2。下列相应的结论中,不正确的是( )
A.该反应属置换反应 B.还原性:I2>Cl2
C.非金属性:I2>Cl2 D.氧化性:KclO3>I2
3. R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合 ( )
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
4.工业上从含硒的废料中提取硒的方法之一是用H2SO4 与NaNO3处理废料获得亚硒酸和少量硒酸。加入盐酸共热,使硒酸转化为亚硒酸(H2SeO4+2HCl==== H2SeO3+ Cl2↑+ H2O),再将SO2通入亚硒酸的溶液中,得到单质硒,据此分析,下列叙述正确的是 ( )
A.H2SeO4氧化性弱于Cl2 B.H2SeO3氧化性弱于H2SO3
C.H2SeO3还原性强于SO2 D.析出1 molSe需H2SeO3、、SO2、H2O各1 mol
5.化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B——X+C,X是一种单质,由此可知X元素( )
A、一定是金属元素
B、一定是非金属元素
C、可能是金属元素,也可能是非金属元素 D、无法确定
6.Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。回答下列问题:
⑴写出Cu2O跟硝酸反应的化学方程式______________________________________。
⑵产物中硝酸铜的物质的量为___________________。
⑶如原混合物中有0.01molCu,则其中Cu2O的物质的量_______________;CuO的物质的量________________。
⑷如原混合物中Cu的物质的量为x,求其中Cu2O、CuO的物质的量及x的取值范围。
(写出计算过程)
7.环境监测测定水中溶解氧的方法是:
①量取amL水样迅速加入足量的固定剂MnSO4(aq)和碱性KI(aq)(含KOH),立即塞好瓶子,并振荡摇匀,使之充分反应。
②测定:开塞后迅速加入适量硫酸(提供H+)使之生成I2,再用6mol/L的Na2S2O3(aq)滴定,消耗了VmL Na2S2O3(aq)(以淀粉为指示剂)。
有关的化学方程式为:2Mn2+ + O2 + 4OH—= 2MnO(OH)2 (该反应极快)
MnO(OH)2 + 2I—+ 4 H+ = Mn2+ + I2 + 3H2O
I2 + 2S2O32—= 2I—+ S4O62—
试回答:
(1)水中溶解氧的量(以g·L-1为单位)为 。
(2)滴定时,以淀粉为指示剂,终点时溶液由 色变为 色。
(3)滴定管经水洗和蒸馏水洗后,直接加滴定剂Na2S2O3(aq),滴定时会导致测定结果
(填“偏高”、“偏低”或“无影响”)。
(4)若打开塞子加硫酸时动作缓慢,测定结果将 (填“偏高”、“偏低”或“无影响”)。
8.由稀有气体元素Xe(氙)形成的一种化合物XeO3 极不稳定,易转化为单质而呈强氧化性。将适量的XeO3 投入30mL0.1mol·L—1 Mn2+的水溶液中,刚好完全反应,放出唯一气体是Xe单质,其在标准状况下的体积为56mL 。则:
(1)有关反应现象是________________________________________
(2)若XeO3 是分子晶体,试写出有关的化学方程式:________________________
(3)若将原溶液稀释至90mL ,则稀释后溶液的PH值为___________
课后练习
1.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2;
②ICl+H2O=HCl+HIO下列有关叙述正确的是
A.反应①中,当转移0.2 mol电子时生成13.6 gZnCl2
B.反应①中,ZnI2既是氧化产物又是还原产物
C.反应①中,ZnCl2既是氧化产物又是还原产物
D.反应②中,ICl既是氧化剂又是还原剂
2.铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和 336mL N2O4气体(气体均为标况),在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
A.7.04g B.8.26g C.8.51g D.9.02g
3.取100mL 18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体在标况下占有的体积为22.4L。将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为( )
A.1∶2 B.2∶1 C.1∶4 D.4∶1
4.已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
![]() (3)此反应的离子反应方程式可表示为:
(3)此反应的离子反应方程式可表示为:
。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
5.(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,下列有关O4的说法不正确的是 :
A.O4与O3、O2都是氧的同素异形体
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4分子内存在极性键
 D.O4的能量比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
D.O4的能量比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
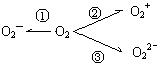
(2)制备O2—、O22—、O2+的化合物是可能的,它们通常是在氧分子进行下列反应时生成的(如右图)。在这些反应中, 相当于氧分子的氧化, 相当于氧分子的还原。(填序号)
(3)写出含有O2—、O22—的各一种物质的化学式: 、
专题(一)答案:
例题 例1C 例2 B
例3(1)升高(2)CuO、Cu2O 或Cu2O;10m/92 mol/L(3)CuO 0.8g Cu2O 0.72g
课堂练习:
| 1 C | 2 C | 3 A | 4 D | 5B |
6.⑴3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
⑵0.025mol
⑶n(Cu2O)=0.005mol n(CuO)=0.005mol
⑷0.005mol<x<0.015mol
7.(1) 48V/a g/L (2) 蓝 无 (3) 偏高 (4) 偏高
8.产生气泡;溶液显紫红色。6Mn2+ +5XeO3 + 9 H2O = 6MnO4- +5 Xe↑ +18 H+
pH=1
课后练习:1B 2C 3A
4.
![]() (1)2MnSO4+5K2S2O8+8H2O 2KMnO4+4K2SO4+8H2SO4
(1)2MnSO4+5K2S2O8+8H2O 2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4
![]() (3)2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
(3)2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
(4)盐酸、氯化钾
5.(1)B、C (2)② ;①、③ (3)K O2、 Na2 O2