第四章 非金属及其化合物
第三讲 章末总结与测试
本章测试目标
1.以金属矿物的开发和利用为例,认识化学方法在实现物质间转化中的作用,体会保护
金属资源的重要性。
2.了解海水资源开发和利用的前景及化学在其中可以发挥的作用。
3.认识煤、石油和天然气等化石燃料综合利用的意义。
4.以聚乙烯为例,了解高分子材料在生活等领域中的应用及可能带来的环境问题。
5.认识化学在环境保护中的作用,树立绿色化学的观念。
内容结构

考题回顾
【例1】关于金属元素在自然界存在的情况的叙述中,正确的是
A、金属元素仅存在于矿物中。
B、金属元素存在于矿物和动物体內,但植物体內不含。
C、少数金属元素以游离态存在,大多数金属元素以化合态存在。
D、金属元素不仅存在矿物中,动物和植物体內也存在少量金属元素。
解析:金属在自然界的分布很广,无论是矿物,还是动植物体內,或多或少地都含有金属元素。这些金属元素除了少数化学性质不活泼以游离态存在外,大多数化学性质较活泼的金属,在自然界以化合态存在。
故选C、D。
【例2】下列化学方程式,能用于工业上冶炼金属镁的是
A、2Na+MgCl2====2NaCl+Mg B、MgCl2(熔化)![]() MgO+Cl2
MgO+Cl2
C、2MgO![]() 2Mg+O2 D、MgO+C
2Mg+O2 D、MgO+C![]() MgO+C
MgO+C
解析:工业上冶炼镁不能用比镁还昂贵的钠作原料去还原MgCl2,可采用电解MgCl2(熔化)的方法。若用氧化镁为原料,也不能采用高温分解法,因为镁属于活泼金属,其氧化物熔点很高(2800℃)。可用焦炭在高温下去还原氧化镁而得到镁。故选B、D。
【例3】1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为:___________,正极材料为:___________。正、负极反应分别为:_______________________、_______________________。
解析:根据原电池构成的条件,活泼金属作负极(失去电子),发生氧化反应;惰性材料作正极(得到电子),发生还原反应。
答案:负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。负极反应:3Al-12e-=3Al3+、正极反应:3O2+6H2O+12e-=12OH-
【例4】(2004广东20)海水的综合利用可以制备金属镁,其流程如下图所示:
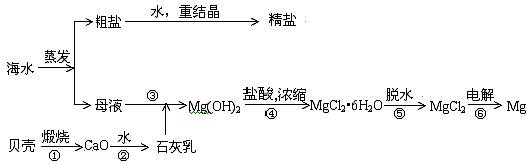
(1)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式_______________________________________;用电解法制取金属镁时,需要无水氯化镁。在干燥的氯化氢气流中加热MgCl2·6H2O时,能得到无水氯化镁,其原因是________ ________。
(2)Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤。
__________________________________________________________________________
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:_________________________________________________________;
过滤时:_________________________________________________________;
蒸发时:_________________________________________________________。
解析:因为MgCl2·6H2O在空气中加热时易发生水解,我们要得到MgCl2,根据抑制水解的条件,只要加对应的酸,也就是只要加热时在干燥的HCl气流中。为使母液Mg2+完全沉淀,往往加入过量的石灰乳,要除去过量的Ca(OH)2,而在不引进新的杂质前提下,我们只加入足量的MgCl2。玻璃棒在实验中通常有以下作用:搅拌(加速溶解或防止液体局部过热)、引流(使液体沿玻璃棒转移到相应容器)。结合题意,我们不难得出有关答案。
答案:
(1)MgCl2•6H2O![]() Mg(OH)Cl + HCl↑ + 5H2O↑
Mg(OH)Cl + HCl↑ + 5H2O↑
MgCl2•6H2O![]() MgO + 2HCl↑ + 5H2O↑或
Mg(OH)Cl
MgO + 2HCl↑ + 5H2O↑或
Mg(OH)Cl![]() MgO + HCl↑
MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
【例5】根据CO还原铁的氧化物的实验装置图(如下图所示),回答下列问题:
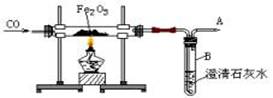
(1)怎样知道硬质玻璃管中Fe2O3已开始反应?______________________________________。
(2)在A处点燃,可观察到什么现象?为什么要点燃?_____________________________。
(3)实验结束时应注意的操作是___________________。
①先停止通入CO ②先熄灭酒精灯,并继续通入CO ③熄灭酒精灯,同时停止通入CO ④先熄灭酒精灯,继续通入CO至被还原的铁粉冷却,并点燃排出的CO气体
解析:(1)当硬玻管中红色物质开始变黑时,B中澄清石灰水开始变混浊,说明开始发生反应;(2)可见浅蓝色的火焰,因CO有毒,为防止CO污染空气,必须点燃或用其它方法处理未反应的CO;(3)④
【例6】下列说法正确的是
A.煤、石油、天然气是当今世界上最重要的三大矿物燃料,是取之不尽的
B.煤是由无机物和有机物所组成的复杂的混合物,主要含有碳和氢两种元素
C.石油主要含有碳和氢两种元素,同时还含有少量的硫、氧、氮等元素
D.煤和石油都是由古代植物遗体埋在地层下或在地壳中经过一系列非常复杂的变化而形成的。
解析:煤、石油、天然气三大矿物燃料在地球上的蕴藏量是有限的,不是取之不尽的,A错;煤主要含有碳元素,而不是碳和氢两种元素,B错;C正确;石油是由古代动植物遗体在地壳中经过非常复杂的变化形成的,D不确切。答案:C。
【例7】汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式________。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是_______。
(3)控制城市空气污染源的方法可以有________。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
解析:提示信息:CO和NO反应,生成可参与大气生态环境循环的无毒气体,并促使SO2的转化。联想:CO和NO反应,生成的无毒气体只能是CO2,故(1)2CO+2NO====2CO2+N2;接触法制硫酸中SO2的催化氧化,故(2)答案是:SO2转化为SO3,产生硫酸酸雾。认真阅读题干“控制城市空气污染源的方法”,(3)的答案应选A、B。
答案:(1)2CO+2NO====2CO2+N2 (2)SO2转化为SO3,产生硫酸酸雾(3)AB
单元过关测试
一、选择题(本题17个小题,每小题3分,共51分)
1.水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是
A.过滤法 B.蒸馏法 C.分液法 D.冰冻法
2.能源问题是当今世界发展的一个主要问题。下列能源符合“绿色化学”的概念的是( )
A.氢气 B.煤 C.沼气 D.石油
3.20世纪90年代初,国际上提出了“预防污染”这一概念,绿色化学是预防污染的重要手段之一,下列各项属于绿色化学的是( )
A.治理污染 B.杜绝污染源 C.减少有毒物 D.处理废弃物
4.物质之间发生化学反应时,一定发生变化的是
A.颜色 B.状态 C.原子核 D.化学键
5.工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( )
A.C3H8![]() C+4H2
B.C3H8
C+4H2
B.C3H8![]() C3H6 + H2
C3H6 + H2
C.C3H8+6H2O![]() 3CO2+10H2
D.2H2O
3CO2+10H2
D.2H2O![]() 2H2+O2
2H2+O2
6.将甲、乙两种有机物组成的混合物进行分离,已知甲、乙的某些性质如下:
| 物质 | 密度/(g·mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
则应采取的分离方法是( )
A.蒸馏 B.干馏 C.分液 D.过滤
7.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,可按如下步骤进行:①把贝壳制成石灰乳 ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解。关于从海水中提取镁,下列说法不正确的是( )
A.此法的优点之一是原料来源丰富 B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解制镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
8.废电池伴着生活垃圾将是人类环境的新公害。下列哪种组合中的元素均是废电池中所含的有害元素?( )
A.Hg、Pb、C、Na B.Cu、K、S、P C.Hg、Pb、Mn、Ni D.Br、N、Pb、As
9.工、农业及城市生活污水中含磷,家用洗涤剂是污水中磷的一个重要来源(洗涤剂中含有磷酸钠),对于处理污水时要不要除去磷,下列说法中正确的是( )
A.磷是生物的营养元素,不必除去 B.含磷的污水是很好的肥料,不必除去
C.含磷污水引起藻类增殖,使水变质,必须除去 D.磷对人无毒,除去与否都无关紧要
10.倡导“免赠贺卡”、“免用一次性木筷”的出发点是( )
A.减少个人经济支出 B.节约木材,保护森林 C.减少扔弃垃圾 D.阻止传染疾病
11.工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是( )
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
A.①② B.②③④ C.①②③ D.全部
12.近年来,我国某些地区出现了私自滥采黄金的现象,提炼过程一般要使用化学药品氰化物,其直接后果是( )
①污染水体 ②破坏臭氧层 ③危害工人的生命与健康 ④破坏植被
A.①② B.①②③ C.②④ D.①③④
13.1838年3月纽卡斯尔市的一些园艺家访问大物理家法拉第,向他请教一个奇特而有趣的问题:为什么别处生长的紫罗兰花都是紫色的,而生长在纽卡斯尔市的紫罗兰却是白色的?法拉第经过一番研究,得出结论,后来被化学家证实并在工业上广泛应用。法拉第的结论是( )
A.遗传变异 B.纽卡斯尔市民用自来水浇花
C.施花肥不当 D.纽卡斯尔空气中SO2含量较高
14.下列各种方法中,适用于炼制相应金属的是( )
A.加热氧化铜 B.氧化镁跟铝粉共热
C.用焦炭还原氧化铜 D.电解熔融氯化钠
15. 铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有
A.两性 B.良好导电性 C.熔点低 D.还原性,在反应中放出大量热
16.有一种粉末它是由铁的氧化物中的一种或者两种组成,取3.04 g粉末加热,同时通入足量的CO使之完全反应,再用过量澄清石灰水把生成气体充分吸收,产生沉淀 5 g。 则该粉末组成是
A.只有Fe2O3 B.只有FeO C.等物质的量的Fe2O3和Fe3O4 D.等物质的量的FeO和Fe3O4
17、下列有关污染的叙述,正确的是
A.酸雨主要是空气中的NO,经氧化与水反应生成HNO3所形成
B.破坏臭氧层的主要物质是氟氯烃等物质
C.温室效应主要是因空气中CO浓度增高造成的
D.发电厂排放大量的废热入河、海中,会使流径的水域溶氧量减少。
二、填空题(本题5个小题,共43分)
18、(8分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:① 取适量A进行铝热反应,产物中有单质B生成;② 另取20 g A全部溶于0.15 L 6.0 mol·![]() 盐酸中,得溶液C;③ 将① 中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空:
盐酸中,得溶液C;③ 将① 中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空:
(1)① 中引发铝热反应的实验操作____ _____ ,产物中的单质B是______。
(2)② 中所发生的各反应的化学方程式是______________________
(3)③ 中所发生的各反应的离子方程式是___________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为____________,c(Fe2+)为__________。
19. (13分)氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
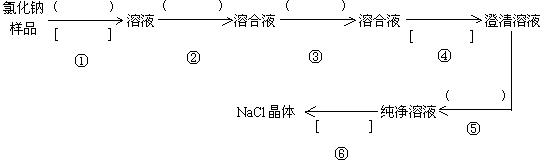
写出有关反应的化学方程式:
第步②
第步③
第步⑤
20.(6分)A、B、C是大家熟悉的且与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有如下转化关系:
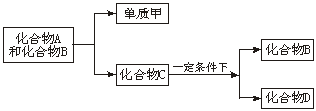
其中D也是日常生活中常见的有机化合物,在一定条件下可与单质甲进一步发生如下变化:D+3甲![]() 3A+2B
3A+2B
试回答下列问题:
(1)在A、B、C、D四种化合物中,所含元素组成相同的是_______________(写物质名称)。
(2)常温下A和B是通过什么途径转化为C的?_______________,写出反应的化学方程式:____________________________。
(3)目前化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响。发生这种变化的主要原因是______________________________________。
21.(7分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中含的三种离子是___________、______________、______________。乙厂的废水中含有另三种离子。如果加一定量______________(选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属______________(填写金属元素符号)
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的___________(填写离子符号)转化为沉淀。经过滤后的废水主要含______________,可用来浇灌农田。
22.(9分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为_______(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 __________________________
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式_____________________________
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因__________________________________________________
三、计算题(共6分)
23..欲测定烟雾中的SO2含量,可做下列实验:取100L该空气(标准状况),通过盛放100mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65g。
(1)试写出SO2和H2O2反应的离子方程式。
(2)写出H2SO4与BaCl2反应的离子方程式。
(3)求100L空气中SO2的体积分数。
参考答案及评分标准:
一、选择题(本题17个小题,每小题3分,共51分)
1、B2、A3、B4、C5、C6、A7、D8、C9、C10、B11、C12、D13、D14、D15、D16、D17、BD
二、填空题(本题5个小题,共43分)
18、(8分)(每空均1分)(1)加少量KClO3,插上Mg条并将其点燃 Fe
(2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O
(3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+
(4)c(Mg2+)=0.67mol·![]() , c( Fe2+)=2.3mol·
, c( Fe2+)=2.3mol·![]() 。
。
19. (13分)① 蒸馏水;溶解 ② BaCl2溶液 ③ Na2CO3溶液 ④ 过滤 ⑤ 稀盐酸
⑥ 蒸发结晶(每1分)
② Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl ,Na2CO3 + BaCl2 = BaCO3↓+2NaCl(2分)
③ BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl(2分)
⑤ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(2分)
20.(6分)(每空2分)
(1)乙醇和葡萄糖
(2)光合作用 6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
(3)森林被乱砍滥伐,破坏了植物的光合作用;同时大量燃烧矿物燃料,从而导致二氧化碳含量的升高,造成了温室效应
21.(7分) (每空1分)
OH-,Cl-,K+ 铁粉 Ag(或银) Ag+,Fe3+,Cl-,OH- KNO3
22.(9分)(1)AlO2-(或Al(OH)4-)(1分)
(2)Zn+2NaOH=Na2ZnO2+H2↑(或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑)(2分)
(3)①③④ (4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制
(2分)
三、计算题(共6分)
23、(1)![]()
(2)![]()
(3)1.12%