绝密★启用前
2006年江苏金凤凰高考试题研究中心(供期中统考用)
化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.回答I卷前,考生务必在答题卡姓名栏内写上自己的姓名、考试科目、准考证号,并用2B铅笔涂写在答题卡上。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题卡和第II卷一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Fe-56
Cl-35.5 Br-80 Ba-137 Cu-64 I-127
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构式为:
HC≡C—C≡C—C≡C—C≡C—C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是
A、该物质属于不饱和烃 B、该分子中所有原子处在一条直线上
C、该分子在一定条件下可发生加成反应 D、该分子碳、氮原子均满足八电子结构
2、为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是
A、碳水化合物 B、碳氢化合物
C、氢气 D、醇类
3、下列物质按不同类别分组,所得组合最不合理的是
(1)糖类(2)塑料(3)石油(4)蛋白质(5)合成纤维(6)棉花(7)陶瓷(8)玻璃(9)天然气(10)水泥(11)合成橡胶(12)煤(13)油脂(14)羊毛
A、(1)(4)(13) B、(2)(5)(11)
C、(7)(8)(11)(14) D、(3)(9)(12)
4、法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称为“零号元素”。下列有关“四中子”粒子的说法错误的是
A、该粒子不显电性
B、该粒子质量数为4
C、该粒子质量比已发现的氢原子大
D、在周期表中与氢元素占同一位置
5、最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A、Mg +2HCl = MgCl2 + H2↑ B、NaOH + HCl = NaCl + H2O
C、NH3 +
HCl = NH4Cl D、H2O +CH3COOH ![]() H3O+ +CH3COO
-
H3O+ +CH3COO
-
6、下列除去杂质的方法正确的是
A、除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
B、除去N2中的少量的CO:通过足量的灼热的CuO粉末
C、除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
D、除去铜粉中混有的铁:加足量稀硝酸,过滤
7、Li-I2 电池广泛用于笔记本电脑、摄像机等,下列有关锂电池工作原理的说法中不正确的是
A、锂在反应中被还原
B、该电池总反应式为:2Li + I2 = 2LiI
C 、锂电池是一种高能电池
D、正极的电极反应式为:I2 + 2e- = 2I-
8、醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程
中,溶液的导电能力变化如右下图所示,有关说法正确的是
A、a、b、c三点溶液的pH:a>b>c
B、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
C、a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D、若在“O”点醋酸双聚成八元环分子,则其结构为:
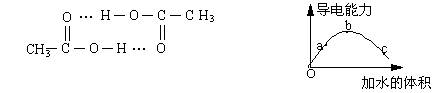
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9、以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A、1L0.1mol·L-1的醋酸溶液中含离子和分子总数是0.1NA
B、22.4L氖气中所含原子数为NA
C、1.6gNH2-离子中所含电子数为NA
D、2gD2O所含中子数为NA
 10、美国美国梅奥诊所的研究人员最近发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:
10、美国美国梅奥诊所的研究人员最近发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:
有关EGCG的说法正确的是
A、EGCG能与碳酸钠溶液反应放出二氧化碳
B、EGCG遇FeCl3溶液能发生显色反应
C、1molEGCG最多可与含10mol氢氧化钠的溶液完全作用
D、EGCG在空气中易氧化
![]() 11、在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)
xC(g),达到平衡后,
11、在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)
xC(g),达到平衡后,
C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、
C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
A、平衡时A 、B的物质的量之比一定为2:1
B、x的值可能是2,也可能是3
C、平衡时A 的物质的量与原平衡一定相等
D、C的体积分数不可能为W%
12、在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A、滴加石蕊试液显红色的溶液 :
Fe3+、NH4+、Cl―、I―
B、pH值为1的溶液 :
Cu2+、Na+、Mg2+、NO3―
C、水电离出来的c(H+)=10-13 mol/L的溶液:
K+、HCO3―、Br―、Ba2+
D、所含溶质为Na2SO4
的溶液:
K+、CO32―、NO3―、Al3+
13、下列反应的离子方程式错误的是
A、足量的CO2通入饱和碳酸钠溶液中
CO2+CO32—+H2O=2HCO3—
B、氢氧化铁与足量的氢溴酸溶液反应
Fe(OH)3+3H+=Fe3++3H2O
C、等物质的量的Ba(OH)2与NH4HSO4在溶液中反应
Ba2++2OH—+NH4++H++SO42—=BaSO4↓+NH3·H2O+H2O
D、向碳酸氢钠溶液中滴入过量澄清石灰水
Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O
14、CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I―==2CuI↓+I2而得到。现以
石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电
解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是
A、2I―-2e-==I2 碘遇淀粉变蓝
B、Cu-2e-==Cu2+ Cu2+ 显蓝色
C、2Cu+4I--4e-==2CuI↓+I2 碘遇淀粉变蓝
D、4OH― –4e-==2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
15、几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A、L、M的单质与稀盐酸反应速率L>M
B、M与T形成的化合物有两性
C、Q、T两元素的氢化物分子间存在氢键
D、L、Q形成的简单离子核外电子数相等
16、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH=4K2CO3+10H2O。
有关此电池的推断正确的是
A、负极反应为14 H2O+7O2+28e—=28 OH—
B、放电一段时间后,负极周围的pH升高
C、每消耗1mol C2H6,则电路上转移的电子为14mol
D、放电过程中KOH的物质的量浓度不变
17、NH3和O2混合气100mL通过红热的铂网,充分反应后的混合气再通过足量水最终收集
到10mL残留气体,则原混合气中O2体积不可能是(气体体积在相同条件下测定)
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
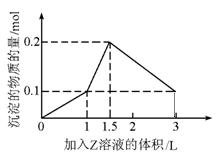 18、1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液
18、1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液
Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、
Z分别是
A、氯化铝、氯化铁、氢氧化钠
B、氯化铝、氯化镁、氢氧化钠
C、偏铝酸钠、氢氧化钡、硫酸
D、偏铝酸钠、氯化钡、硫酸
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19、(10分)我市某企业排放的废水中约含有15%的FeSO4、7%的H2SO4、0.50%的Ag2SO4、0.34%的Al2(SO4)3及一些污泥。某研究性学习课题组为了帮助该企业科学处理污水,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。经查阅资料,FeSO4 和Al2(SO4)3 在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶解度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(Ⅰ)完成得到Ag的实验方案:
(1)将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,以洗去油污。
(2)将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用。
(3)向(2)滤液中加入稍过量的洗涤过的废铁屑,其中发生反应的离子方程式是
____________________________________________________。
(4)________________________________________________________,分离出Ag。
(Ⅱ)完成除去Al3+,得到主要成分为FeSO4·7H2O晶体的实验方案。
(5)将第(3)步与第(4)步所得滤液混合后,加入少量硫酸至混合液的pH为3~4后,
________________________________________________,滤出FeSO4·7H2O晶体。
20、(12分)实验室现有下列药品:①蒸馏水;②用HNO3酸化的AgNO3溶液;③熟石灰;④Na2CO3 ;⑤NaCl;⑥食醋;⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等糊状物)。某课外兴趣小组同学准备进行下列实验研究:
(1) 利用上述药品制NaOH溶液的化学方程式是
__________________________________________________。
(2)为制备NH3,可先从废干电池中制备NH4Cl。假设将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发滤液,以制得干燥的NH4Cl晶体。你认为这一设想是否合理?答:___,其理由是____________________________________________。
(3)他们在进行除去淀粉溶液中食盐的实验时,用鸡蛋壳膜自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口,这一实验的操作名称为________________。要保证全部除去淀粉溶液里的食盐,实验中必须________________________________。
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的实验方案是
___________________________________________________________________-
________________________________________________________。
②请运用化学原理对你的方案予以解释
_____________________________________________________________________
________________________________________________________________________。
四、(本题包括2小题,共18分)
21、(8分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
_____________ > ______________ 。
(2)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式:_____________________________________________________________ 。
(3)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应、且生成气体的离子方程式:_______________________________________________________________。
(4)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池的电极反应方程式:
负极 :____________________________________;
正极 :_______________________________________。
22、(10分)已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
试回答下列:
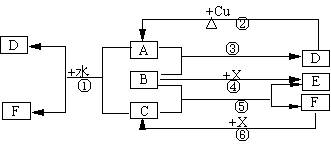
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 。
(2)B的电子式为: 。
(3)写出反应②的化学方程式: 。
(4)写出反应①、⑥的离子方程式
①__________________________________________________;
⑥__________________________________________________。
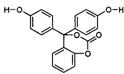
五、(本题包括2小题,共18分)
![]()
|
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
(1)该有机物分子中的三个苯环_________ 共平面
(选填“能”或“不能”)。
(2)该有机物的的化学式为 ________________。
(3)该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量较小钠盐的化学式为 ____________________________________________________________________。
(4)1mol该有机物在铜铬氧化物催化下能与 ______________mol氢气充分反应。
24、(10分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为: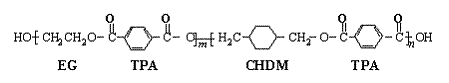
已知:
(1)![]()
(2)RCOOR1 +R2OH ![]() RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
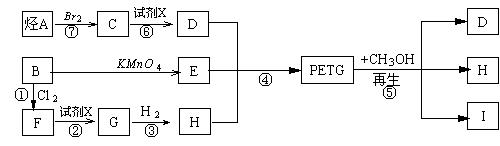
试回答下列:
(1)反应②⑥加入的试剂X是 ; (2)⑤的反应类型是 ;
(3)写出结构简式:B I ;(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= ∶ ∶ (用m、n表示)
(5)写出化学方程式:
反应③ _;反应⑥ _____。
六、(本题包括2小题,共18分)
25、(6分)有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液跟2.00mol/LNaOH溶液反应,共用去35.00mL碱液时恰好中和。试完成下列
(1)则混合溶液中硝酸的物质的量浓度 c (HNO3) = mol/L
(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,反应的离子方程式为:
在标准状况产生的气体体积为 mL。
26、(12分)在标准状况下将cmolCl2通入含amolFeBr2、bmolFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1) 将下表中空格填满:
| c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式 (只要求写盐类化合物) |
| FeBr2、FeI2、FeCl2 | |
| b≤c<1/2(a+3b) | |
| FeBr3、FeCl3 | |
| FeCl3 |
(2)若a=b=1 、c=2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a=b=1 、c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应):_________________________________________________________.
2005年高校招生统一考试试卷
化学参考答案及评分标准
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.C 2.D 3.D 4.B 5.C 6.B 7.A 8.D
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.CD 10.BD 11.AB 12. B 13.AD 14.C 15.AB 16.C 17.B 18.C
三、(本题包括2小题,共22分)
19. Fe+2Ag+=Fe2++2Ag , Fe2O3+6H+=2Fe3++3H2O, Fe+2Fe3+=3Fe2+ , Fe+2H+=Fe2++H2↑ (4分) 将(3)的滤渣溶入足量的稀硫酸 过滤,滤液保留待用 (2分) 将溶液加热、蒸发浓缩、冷却结晶(2分)
![]()
![]() 20.(1)Ca(OH)2 + Na2CO3 =2NaOH + CaCO3
↓ (2分) (2)不合理,因为NH4Cl受热分解,故蒸发灼烧不可能得到NH4Cl晶体;同时,蒸发会使溶于水中的淀粉呈糊状物 (2分) (3)渗析
必须更换渗析用的蒸馏水,至渗析液中检不出Cl- (4分) (4) ①在浓氨水中滴加浓NaOH溶液或同时加入浓NaOH溶液和NH4Cl晶体 (2分) ②氨水中存在以下平衡:NH4++OH- NH3·H2O
NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3 (2分)
20.(1)Ca(OH)2 + Na2CO3 =2NaOH + CaCO3
↓ (2分) (2)不合理,因为NH4Cl受热分解,故蒸发灼烧不可能得到NH4Cl晶体;同时,蒸发会使溶于水中的淀粉呈糊状物 (2分) (3)渗析
必须更换渗析用的蒸馏水,至渗析液中检不出Cl- (4分) (4) ①在浓氨水中滴加浓NaOH溶液或同时加入浓NaOH溶液和NH4Cl晶体 (2分) ②氨水中存在以下平衡:NH4++OH- NH3·H2O
NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3 (2分)
四、(本题包括2小题,共18分)
21、(10分)(1)HClO4>H2SO4(2分) (2)Cl2 + 2NaOH = NaCl + NaClO + H2O(2分)
(3)H+ + HSO3— = SO2↑+H2O (2分)
(4)2H2 + 4OH— -4e = 4H2O O2 + 2H2O + 4e = 4OH—(各2分)
22、每空均2分
(1)X>C>B>D(或写作MnO2 >Cl2> H2O2 >H2SO4)
(2)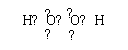
(3)Cu +2H2SO4(浓)![]() CuSO4 +SO2 ↑+2H2O
CuSO4 +SO2 ↑+2H2O
(4)Cl2 +SO2 +2H2O = 4H+ +SO42-+2Cl-
MnO2
+4H+ + 2Cl-![]() Mn2+ +Cl2 ↑+2H2O
Mn2+ +Cl2 ↑+2H2O
五、(本题包括2小题,共18分)
23.(10分)(1)不能 (2分) (2)C20H14O5(2分) (3)Na2CO3 (3分) (4)3 (3分)
24、每空均2分,共14分
(1)NaOH溶液(2)取代(或醇解);
(3)![]()
(4)m∶(m+n)∶n
(5)③ ![]() +5H2
+5H2 ![]()
![]()
⑥CH2Br-CH2Br +2H2O ![]() CH2OH -CH 2OH +2HBr
CH2OH -CH 2OH +2HBr
六、(本题包括2小题,共18分)
25、(每空均2分,共6分)
(1)3.00mol/L
(2) 3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑ +4H2O ;373.1mL
26.(10分)
(1)(每空1分),
| 0<c<b | |
| FeBr2 FeBr3 FeCl2 FeCl3 | |
| 1/2(a+3b) ≤c<3/2(a+b) | |
| c ≥ 3/2(a+b) |
(2)FeBr3、FeCl3 1:2 (每空2分)
(3)4Fe2+ + 4I- + 2Br- +5Cl2 ===4Fe3+ + 2I2 +Br2 + 10Cl-(2分)