08届高考化学模拟考试题二
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.
可能用到的相对原子质量:C:12 Cl:35.5 O:16
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)
1.下列做法不利于改善环境的是( )
A.焚烧农作物秸秆 B.提倡使用农家肥 C.用![]() 作还原剂冶炼金属 D.限制燃油汽车数量的增加
作还原剂冶炼金属 D.限制燃油汽车数量的增加
2.1986年,华裔科学家李远哲获诺贝尔化学奖.李远哲的主要贡献是( )
A.提出原子、分子的概念 B.研究交叉分子束实验
C.发现氯气并开发其用途 D.实现合成氨的工业化生产
3.“能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )

A.煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
4.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.NaCl和HCl D.
C.NaCl和HCl D.![]() 和KCl
和KCl
5.将某溶液逐滴加入![]() 溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是( )
溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是( )
A.2mol/L
HCl溶液 B.2mol/L
NaOH溶液 C.2mol/L![]() 溶液 D.硅酸溶液
溶液 D.硅酸溶液
6.液溴易挥发,实验室保存时加适量水形成水封,液面仍充满红棕色的溴蒸气.先将试剂瓶倾斜,缓缓地向试管中倾倒,则可以观察到首先被倒入试管的是( )
A.液溴 B.水 C.溴水 D.溴蒸气
7.已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是( )
A.LiOH加热时,不会分解
B.![]() 加热时,不会分解
加热时,不会分解
C.Li在氧气中燃烧生成![]() D.Li与稀硫酸反应生成
D.Li与稀硫酸反应生成![]()
8.已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52mol/L,试判断47.5%酒精溶液的物质的量浓度为( )
A.大于8.26mol/L B.等于8.26mol/L C.小于8.26mol/L D.无法判断
9.汽车尾气造成铅污染,其原因是汽油中溶有含铅物质(防爆剂),该防爆剂的化学式为( )
A.PbS
B.![]() C.
C.![]() D.
D.![]()
10.用来检验集气瓶中是否充满![]() 的滤纸应吸附( )
的滤纸应吸附( )
①硝酸铅 ②盐酸 ③氨水 ④酸性高锰钾溶液 ⑤硫酸铜溶液 ⑥品红溶液
A.①②④⑤ B.②④⑤⑥ C.④⑥ D.④⑤⑥
11.下列微粒中与![]() 离子所含质子数、电子数相等,且化学键类型也相同的微粒是( )
离子所含质子数、电子数相等,且化学键类型也相同的微粒是( )
A.![]() B.
B.![]() C.Ne D.
C.Ne D.![]()
12.酸雨对下列物质的腐蚀作用明显的是( )
A.铜制塑像 B.大理石雕刻 C.水泥路面 D.铝制窗框
13.欲使![]() 稀溶液中
稀溶液中![]() 比值增大,可采取的措施是( )
比值增大,可采取的措施是( )
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体![]()
14.从海水中提取溴有如下反应:![]()
![]() ,与上述反应在氧化还原原理上最相似的是( )
,与上述反应在氧化还原原理上最相似的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.在40mL
18mol·![]() 溶液中加入12g碳并加热,充分反应后,被还原的
溶液中加入12g碳并加热,充分反应后,被还原的![]() 的物质的量为( )
的物质的量为( )
A.等于1.00mol B.等于0.72mol C.小于0.72mol D.小于1.00mol
16.12mL
0.1mol·![]() 的亚硫酸溶液,恰好跟20mL浓度为0.02mol·
的亚硫酸溶液,恰好跟20mL浓度为0.02mol·![]() 的重铬酸钾(
的重铬酸钾(![]() )溶液完全反应,则元素铬(Cr)在还原产物中的化合价是( )
)溶液完全反应,则元素铬(Cr)在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+6
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17.(10分)用氯气对饮水消毒会使饮用水中的有机物发生氯代,生成有机含氯化合物,对人体有潜在的危害作用.世界环保联盟即将全面禁止用氯气对饮用水消毒,建议采用广谱高效的二氧化氯(![]() ).
).
(1)二氧化氯具有很强的氧化性,常被用作消毒剂,其消毒的效率(以单位质量得到电子的物质的量表示),是![]() 的_____
___倍.
的_____
___倍.
(2)使用![]() 作饮用水消毒剂的优点是_____________
___.
作饮用水消毒剂的优点是_____________
___.
(3)目前,欧洲一些国家用![]() 氧化浓盐酸来制取
氧化浓盐酸来制取![]() ,同时有
,同时有![]() 生成,且
生成,且![]() 体积为
体积为![]() 的一半.表示这一反应的化学方程式是___________________________
___.
的一半.表示这一反应的化学方程式是___________________________
___.
(4)我国最近研究成功用![]() 氧化亚氯酸钠(在氮气保护下)制得
氧化亚氯酸钠(在氮气保护下)制得![]() ,表示这一反应的化学方程式_____
___,这一方法的优点是_____
___.
,表示这一反应的化学方程式_____
___,这一方法的优点是_____
___.
(5)在![]() 酸性条件下,用
酸性条件下,用![]() 还原
还原![]() 也可制得
也可制得![]() ,表示这一反应的化学方程式是_________________________________________________
___.
,表示这一反应的化学方程式是_________________________________________________
___.
18.(10分)氨的喷泉试验,基本实验操作步骤可分解为以下几步:
A.使倒置烧瓶下端的玻璃管插入盛有水的烧杯里(水中事先加入酚酞试液)
B.将带有喷嘴和止水夹的长玻璃管和吸满水的胶头滴管先后插入双乳橡皮塞
C.挤压滴管的胶头,使少量的水进入烧瓶
D.取一根带尖嘴的玻璃管,玻璃管的另一端用橡胶管连接另一玻璃管,并用止水夹夹住橡胶管
E.在干燥的圆底烧瓶中充满氨气
F.将圆底烧瓶用铁夹固定在铁架台上
G.将止水夹移到下端玻璃管上
H.用带有玻璃管和胶头滴管的塞子塞紧瓶口
(1)正确的操作步骤的顺序(填字母)________→________→________→H→A→________G→________
(2)喷泉实验成功的必要条件是
①__________________________________________________ ____;
②___________________________________________________ ___;
③___________________________________________________ ___.
(3)上述步骤操作中,怎样证明圆底烧瓶中充满了氨气?
(4)实验室制取少量氨气,常用的药品是________和________混合加热.快速制取氨气常加热浓氨水,但当氨水浓度低于20%,在一定条件下,为仍能快速制取氨气,应采取的措施是________,理由是_________________________________________________________ ___.
三、(本题包括两小题,共20分)
19.(10分)松油醇是一种调香香精,它是a 、b 、g 三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
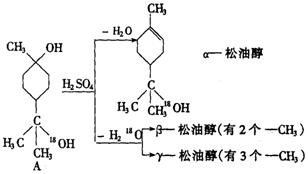
试回答:
(1)a —松油醇的分子式________;a —松油醇所属的有机物类别是________.
(2)写结构简式:b—松油醇________,g —松油醇________,它们的关系是_____
_______________________________.
(3)a —松油醇能发生的反应类型是_________________________________________
________________________.
20.(10分)已知:

某高分子化合物![]() 发生如下转化:
发生如下转化:
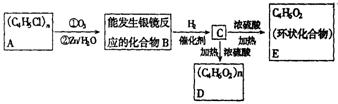
(1)写出A、E的结构简式:A_______________________,E_______________________.
(2)写出B转化为C的化学方程式:_______________________________________________________.
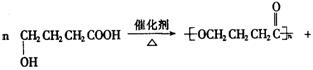
(3)写出C转化为D的化学方程式:_______________________________________________________.
四、(本题包括两小题,共16分)
21.(8分)某化学反应2A![]() B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
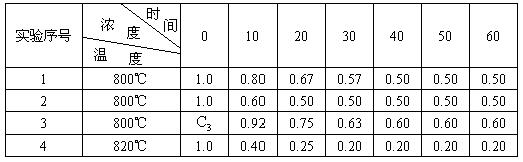
根据上述数据,完成下列填空:
(1)实验1,反应在10至20分钟时间内平均速率为________mol·![]() ,实验2中还隐含的条件是________________________________________________________________________________________.
,实验2中还隐含的条件是________________________________________________________________________________________.
(2)设实验3的反应速率为![]() ,实验1的反应速率为
,实验1的反应速率为![]() ,若
,若![]() >
>![]() ,则
,则![]() ________1.0moL(填>、=、<
________1.0moL(填>、=、<![]() ,理由是_________________________________________________________________.
,理由是_________________________________________________________________.
(3)该反应是________反应(选填吸热、放热),理由是___________________________________________.
22.(8分)下列转化关系,A~L均是中学化学中常见的物质.其中D为金属单质,构成D的元素在元素周期表中位于第四周期、Ⅷ族;B在常温常压下为无色液体;G为不溶于水但可溶于酸的白色固体,其水溶液能使酚酞试液变红;I为无色气体且能使湿润的红色石蕊试纸变蓝;L为无色气体,遇空气变为红棕色.
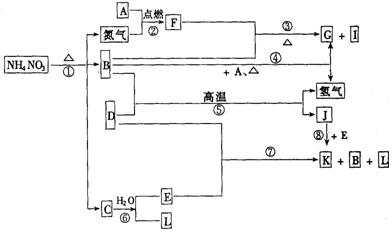
请回答:
(1)构成单质A的元素在周期表中处于________周期,________族.
(2)I物质的电子式为_______________,F物质的化学式为____________________;它们的晶体类型分别为_________________________________,_______________________________________.
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式)
③____________________________________________________________
⑤____________________________________________________________
参考答案
一、
1.A 2.B 3.C 4.B
5.A 先凝聚后中和 6.C
7.D 锂的单质及化合物的性质仿照镁对应的单质及化合物的性质来推.
8.A ![]()
![]() ;
;
![]() ,联立得:
,联立得:![]() 、
、![]() 故
故![]() >8.26mol·
>8.26mol·![]()
9.C 汽油里主要是碳、氢元素,故只能以C结合为宜.
10.C 因为![]() 气体比空气重,不易逸出,验满时,应把吸附药品的试纸放在瓶口,其中能变色的是酸性高锰酸钾溶液及品红溶液.
气体比空气重,不易逸出,验满时,应把吸附药品的试纸放在瓶口,其中能变色的是酸性高锰酸钾溶液及品红溶液.![]() 具有氧化性又具有还原性,遇到强氧化剂表现还原性,使
具有氧化性又具有还原性,遇到强氧化剂表现还原性,使![]() 被褪色;
被褪色;![]() 又能和品红结合,形成无色物质,也能褪色,所以C正确.
又能和品红结合,形成无色物质,也能褪色,所以C正确.
11.B ![]() 为11质子和10电子,含有共价键、配位键的微粒.故
为11质子和10电子,含有共价键、配位键的微粒.故![]() 同.
同.
12.D 铝是活泼的金属最易受到酸的腐蚀.
13.C 欲使![]() 溶液中
溶液中![]() 比值增大,应采取措施抑制
比值增大,应采取措施抑制![]() 水解,而又不增大
水解,而又不增大![]() ,根据水解平衡:
,根据水解平衡:![]()
![]()
![]()
![]() ,考虑各选项.C选项正确.
,考虑各选项.C选项正确.
14.C 按氧化还原反应发生在同一元素间进行.
15.C 本题利用氧化还原反应,考查是否注意反应进程中![]() 的物质的量浓度变化对化学反应程度的影响,能否对化学反应有严密的思维能力,是近年高考中值得注意的题型.本题依反应如:
的物质的量浓度变化对化学反应程度的影响,能否对化学反应有严密的思维能力,是近年高考中值得注意的题型.本题依反应如:
C + ![]()
12 1mol 1mol
12(过量) 18×0.04(mol) xmol
因碳过量,按浓![]() 的量计算,解得x=0.72mol,且由于浓
的量计算,解得x=0.72mol,且由于浓![]() 在反应过程中有水生成且
在反应过程中有水生成且![]() 消耗使浓
消耗使浓![]() 逐渐被稀释,结果能使反应中止,因此被还原的
逐渐被稀释,结果能使反应中止,因此被还原的![]() 的物质的量必小于0.72mol.
的物质的量必小于0.72mol.
16.C 本题是氧化还原反应,根据题意可知亚硫酸钠是还原剂,+4价的硫元素被氧化,重铬酸钾是氧化剂,+6价的铬元素被还原.设还原产物中铬的化合价为x.
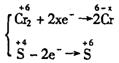
反应中得失电子数相等,所以:0.020L×0.02mol·![]() ×2(6-x)=0.012L×0.1mol·
×2(6-x)=0.012L×0.1mol·![]() ×2 x=3
×2 x=3
二、
17.(1)![]() 和
和![]() 在杀菌过程中,
在杀菌过程中,![]() 元素的化合价变化分别为:
元素的化合价变化分别为:![]() ,
,![]() ,根据题意易得
,根据题意易得![]()
(2)由题干和(1)可知,一是![]() 的消毒效率高,二是
的消毒效率高,二是![]() 不会和水中的有机物生成对人体有害的含氯化合物.
不会和水中的有机物生成对人体有害的含氯化合物.
(3)![]()
(4)![]() 无
无![]() 杂质,质量好,产率高
杂质,质量好,产率高
(5)![]()
18.(1)D→B→E→H→A→F→G→C
(2)①烧瓶要干燥;②装置不漏气;③气体收集满
(3)将蘸有浓HCl的玻璃棒靠近瓶口,若有白烟产生,证明氨气已收集满.
(4)![]() 和
和![]() ,将氨水加到固体NaOH(或生石灰)中并加热,NaOH溶于水放热,且电离出
,将氨水加到固体NaOH(或生石灰)中并加热,NaOH溶于水放热,且电离出![]() 抑制氨水电离,从而产生大量氨气.
抑制氨水电离,从而产生大量氨气.
三、
19.(1)![]() 不饱和一元醇
不饱和一元醇
(2) 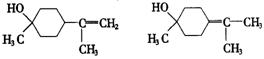 互为同分异构体
互为同分异构体
(3)加成 氧化 消去 取代(酯化)
20.(1)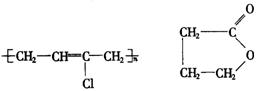
(2)![]()
![]()
(3)
![]()
四、
21.(1)0.013 实验过程中使用了催化剂
(2)> 浓度越大,反应速率越快
(3)吸热 温度升高时,平衡向右移动
22.(1)第三 ⅡA
(2) ![]()
![]() 分子晶体 离子晶体
分子晶体 离子晶体
(3)![]()
![]()