08届高考化学模拟考试题六
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.
可能用到的相对原子质量:C:12 H:1 N:14 O:32 Cu:64 Ba:137 Ag:108 S:32 Cl:35.5
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)
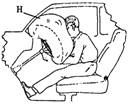 1.如图所示,H是一种汽车安全袋,内部贮存化学物质,当汽车高速前进过程中受到撞击时,化学物质会在瞬间爆炸产生大量气体,充满气袋,填补在乘员与挡风玻璃、仪表板、方向盘之间防止乘员受伤,则安全袋中贮存的化学物质可能是( )
1.如图所示,H是一种汽车安全袋,内部贮存化学物质,当汽车高速前进过程中受到撞击时,化学物质会在瞬间爆炸产生大量气体,充满气袋,填补在乘员与挡风玻璃、仪表板、方向盘之间防止乘员受伤,则安全袋中贮存的化学物质可能是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
2.脑白金的主要成分的结构简式为: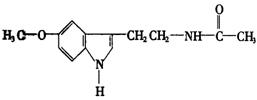 下列对脑白金主要成分的推论错误的是( )
下列对脑白金主要成分的推论错误的是( )
A.其分子式为![]() B.能水解生成乙酸
B.能水解生成乙酸
C.能与溴水发生加成反应 D.其营养成分及官能团与葡萄糖相同
3.由一个氧原子,一个氮原子,7个氢原子和若干个碳原子组成的有机物,其碳原子的个数至少为( )
A.2 B.3 C.4 D.5
4.下列离子方程式中书写正确的是( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液 ![]()
B.氯化铁溶液中通入硫化氢气体 ![]()
C.次氯酸钙溶液中通入过量二氧化碳 ![]()
D.氯化亚铁溶液中加入硝酸 ![]()
5.压强变化不会使下列平衡发生移动的是( )
A.![]() (g)+
(g)+![]() (g)
(g)![]()
![]() (g) B.
(g) B.![]() (g)+
(g)+![]() (g)
(g)![]()
![]() (g)
(g)
C.C(s)+![]() (g)
(g)![]() 2CO(g) D.
2CO(g) D.![]() (g)+
(g)+![]() (g)
(g)![]() 2HI(g)
2HI(g)
6.在100mL0.10mol/L的![]() 溶液中加入100mL溶有2.08g
溶液中加入100mL溶有2.08g ![]() 的溶液,再加入100mL溶有0.010mol
的溶液,再加入100mL溶有0.010mol![]() 的溶液,充分反应.下列说法中正确的是( )
的溶液,充分反应.下列说法中正确的是( )
A.最终得到白色沉淀和无色溶液 B.最终得到白色沉淀是等物质的量的两种化合物的混合物
C.在最终的溶液中n(![]() )=0.02mol D.在最终的溶液中c(
)=0.02mol D.在最终的溶液中c(![]() )=0.01mol/L
)=0.01mol/L
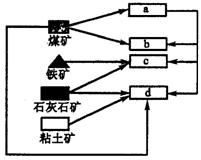 7.如图为某地的工业联系图.我国中西部地区大型铁矿附近有炼焦煤、石灰石、粘土矿和丰富的水资源,随着大型铁矿的开发,该地将建立焦化厂、钢铁厂、发电厂和水泥厂.通过分析,这四个工厂的正确布局应为( )
7.如图为某地的工业联系图.我国中西部地区大型铁矿附近有炼焦煤、石灰石、粘土矿和丰富的水资源,随着大型铁矿的开发,该地将建立焦化厂、钢铁厂、发电厂和水泥厂.通过分析,这四个工厂的正确布局应为( )
A.a为焦化厂、b为钢铁厂、c为水泥厂、d为发电厂
B.a为发电厂、b为焦化厂、c为钢铁厂、d为水泥厂
C.a为焦化厂、b为钢铁厂、c为发电厂、d为水泥厂
D.a为钢铁厂、b为水泥厂、c为发电厂、d为焦化厂
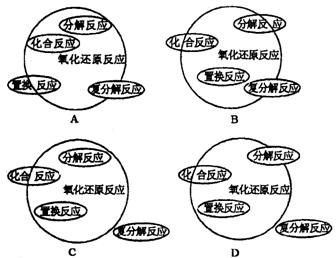
8.能正确表示四种基本类型反应与氧化还原反应关系的示意图是( )
9.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的![]() 和
和![]() B.质量相等、密度不等的
B.质量相等、密度不等的![]() 和
和![]()
C.体积相同、密度不相等的CO和![]() D.压强相同,体积相同的
D.压强相同,体积相同的![]() 和
和![]()
10.两个硫酸分子可以脱去一分子水生成焦硫酸(![]() ),已知硫酸分子中有四个硫氧键,焦硫酸分子中硫氧键的数目是( )
),已知硫酸分子中有四个硫氧键,焦硫酸分子中硫氧键的数目是( )
A.4 B.6 C.7 D.8
11.试管装有足量的煤油和水的混合物,静置后投入一小块碱金属.可观察到金属在煤油和水的界面附近上下往复运动,下列说法不正确的是( )
A.此碱金属可能是钾或钠 B.反应一段时间煤油会燃烧
C.碱金属上下运动是由于与水反应产生了氢气 D.若是金属锂则不能观察到上述现象
12.在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.在硫酸铝、硫酸钾和明矾的混合溶液中,如果![]() 的离子浓度为0.2mol·
的离子浓度为0.2mol·![]() ,当加入等体积0.2mol·
,当加入等体积0.2mol·![]() KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中
KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中![]() 离子浓度约是( )
离子浓度约是( )
A.0.125mol·![]() B.0.225mol·
B.0.225mol·![]() C.0.250mol·
C.0.250mol·![]() D.0.450mol·
D.0.450mol·![]()
14.中学化学实验中常见的使用温度计如下三种情况:①温度计的液泡浸没在液体反应物液面以下并接近容器的底部;②温度计的液泡置于水浴中;③温度计的液泡置于蒸馏烧瓶的支管处.下列实验使用温度计正确的是( )
A.苯的硝化反应 ①
B.酒精和浓硫酸混合加热制乙烯 ①
C.测定硝酸钾在水中的溶解度 ③
D.分离苯和硝基苯的混合物 ②
15.下列说法中正确的是( )
A.离子化合物中可能含有共价键 B.共价化合物一定形成原子晶体
C.金属元素在化合物中只能形成离子键 D.全部由非金属元素构成的化合物,一定为共价化合物
16.以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验.数据记录如下表:
| 项目 | 待测液 | 消耗标准盐酸 (0.1mol/L)的体积 |
| ① | 20mL NaOH溶液 |
|
| ② | 20mL NaOH溶液+10mL 10mL |
|
| ③ | 敞口隔夜放置的20mL NaOH溶液 |
|
该新制的NaOH溶液的浓度c(NaOH)合理的是( )
A.c(NaOH)=0.10×(![]() +
+![]() +
+![]() )/(3×20)mol·
)/(3×20)mol·![]()
B.c(NaOH)=0.10×(![]() +
+![]() )/(2×20)mol·
)/(2×20)mol·![]()
C.c(NaOH)=0.10×(![]() +
+![]() )/(2×20)mol·
)/(2×20)mol·![]()
D.c(NaOH)=0.10×![]() /20mol·
/20mol·![]()
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17.(8分)在120℃,101.3kPa条件,有2L ![]() 、2L CO、1L
、2L CO、1L ![]() 、0.5L
、0.5L ![]() 和1L
和1L ![]() 组成的混合气体.将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管.假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
组成的混合气体.将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管.假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
(1)尾气是否有可能是单一气体________(填可能或不可能).若可能,该气体是________.
(2)原气体中是否有几种(或一种)不可能再存在于尾气之中________(填有或没有)若有,它们(或它)是______________________.
(3)原气体中是否有几种(或一种)肯定存在于尾气之中________(填有或没有)若有,它们(或它)是_____ ___.
18.(10分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
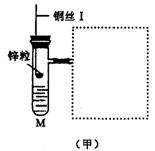
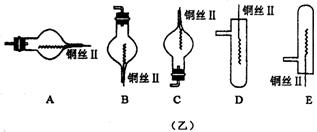
(1)在图甲中,试管M中的液体应选用__________ _____________________.
(2)在图示的虚线框中应连入的最合适的装置是___ _____(填代号)
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有________________________________
_________________________________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是_____________________________________________
_____________________________________________________________________________________________
(5)实验时,细铜丝“Ⅱ”的操作方法是____________________________________________________
_____________________________________________________________________________________________
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为________;发生反应的离子方程式为______________________________________________________________________________.
三、(本题包括两小题,共20分)
19.(10分)现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和![]() 、
、![]() 的混合气体0.0270mol(不考虑
的混合气体0.0270mol(不考虑![]() ).请填空:
).请填空:
(1)混合气体中![]() 的物质的量为________________________mol.
的物质的量为________________________mol.
(2)将此组成的混合气体通入足量水中,剩余气体在标准状况下体积为________________________mL.
(3)该反应中金属元素的化合价________________________(填升高、降低、不变).
(4)写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目.
20.(10分)如图中A至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
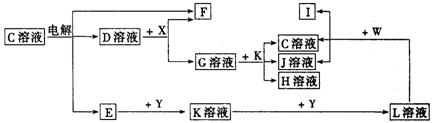
填写下列空白:
(1)E是________________________(化学式),Y元素在周期表中的位置是________________________.
(2)用电子式表示W的形成过程__________________________________________________________.
(3)写出K+G→H+J+C的离子方程式______________________________________________________.
(4)设计实验分离H和J(写出加入试剂和操作方法):______________________________________.
四、(本题包括两小题,共16分)
21.(8分)已知①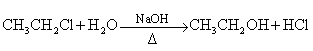
②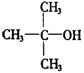 不能氧化为醛或羧酸.
不能氧化为醛或羧酸.
PMAA是一种“智能型”大分子,可应用于生物制药中大分子和小分子的分离.下列是以A物质为起始反应物合成PMAA的路线:
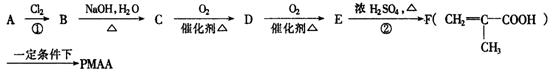
(1)分别写出A和PMAA的结构简式A________________________;PMAA________________________.
(2)上述反应过程中①②的反应类型分别是①______________________________;②______________.
(3)写出E→F的化学方程式_______________________________________________________________.
22.(8分)有![]() 和CO的混合气体0.5mol在足量
和CO的混合气体0.5mol在足量![]() 中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量
中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量![]() 吸收,
吸收,![]() 增重15g.
增重15g.
(1)写出燃烧后的产物与![]() 反应的化学方程式.
反应的化学方程式.
(2)原混合气体![]() =________L,
=________L,![]() =________L(标准状况下),混合气体的平均相对分子质量为:
=________L(标准状况下),混合气体的平均相对分子质量为:![]() =_______________.
=_______________.
参考答案
一、 1.B 撞击时能分解产生大量气体的物质,![]()
2.D 存在—C![]() C—和
C—和![]() 葡萄糖的官能团为—OH,—CHO.
葡萄糖的官能团为—OH,—CHO.
3.A 由![]() ,2n+3=7 n=2.
,2n+3=7 n=2.
4.D A应生成![]() ,B中
,B中![]() 为弱电解质,C中应生成
为弱电解质,C中应生成![]() .
.
5.D 气体物质在反应式两边体积无变化的反应.
6.B 因为![]() 为0.01mol,
为0.01mol,![]() 为0.01mol反应生成0.01molAgCl↓余0.01mol
为0.01mol反应生成0.01molAgCl↓余0.01mol![]() 再加入0.01mol
再加入0.01mol![]() 后生成0.01mol
后生成0.01mol![]() 溶液中为
溶液中为![]() 和
和![]() ,故
,故![]() .
.
7.B 由所选原料决定:c用铁矿石和石灰石作原料为钢铁厂,d用粘土和石灰石作原料为水泥厂,b为焦化厂,a为发电厂.
8.D
9.B A无压强,C质量不相同,D无温度.
10.D 一个硫形成4个硫氧键.
11.B 放出的热量被水吸收,不会引起煤油燃烧.
12.C 放电使![]()
13.B 设两溶液均为1升,则![]()
![]()
![]() 由电中性知原溶液中的
由电中性知原溶液中的![]() 为2×0.2-0.05×3=0.25mol
为2×0.2-0.05×3=0.25mol
混合后溶液中的![]()
14.B
15.A 金属离子与分子间形成络离子为共价键.
16.B 酚酞为指示剂,![]() ,故
,故![]() 无意义.
无意义.
二、 17.[答案](1)不可能 (2)有;![]() ; (3)没有
; (3)没有
[解析]因Cu粉、C粉仅有还原性,而CuO有氧化性,气体![]() 、
、![]() 、
、![]() 有氧化性,CO、
有氧化性,CO、![]() 有还原性,故无论如何排列,
有还原性,故无论如何排列,![]() 、
、![]() 、
、![]() 可变为
可变为![]() 、CO、CO、
、CO、CO、![]() 可变为
可变为![]() ,故尾气中可能有CO、
,故尾气中可能有CO、![]() 或CO,
或CO,![]() .
.
18.(1)稀![]() (2)B
(2)B
(3)①易于控制![]() 的发生与停止;②形成Cn—Zn原电池,加快反应速率
的发生与停止;②形成Cn—Zn原电池,加快反应速率
(4)锌粒溶解,有气泡产生
(5)先在酒精灯上灼烧到红热状态,然后再迅速插入干燥管中
(6)NaOH溶液;![]() 或
或![]()
![]()
三、 19.(1)0.024 (2)89.6 (3)升高
20.(1)![]() ,四周期Ⅷ族
,四周期Ⅷ族
(2) ![]()
(3)![]()
(4)将沉淀移入足量NaOH溶液中,充分反应后过滤,洗涤得![]() 沉淀.向滤液中通入过量
沉淀.向滤液中通入过量![]() ,过滤洗涤得
,过滤洗涤得![]() 沉淀
沉淀
四、 21.(1) 
(2)①加成反应 ②消去反应
(3)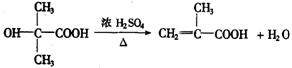
22.无论如何混合![]()
![]() 固体增重
固体增重
2 1 2×28
0.5 28×0.5=14g
所以![]() 使
使![]() 且增重15-14=1g,
且增重15-14=1g,![]() 为
为![]() ∴
∴ ![]()
![]()
(1)![]()
![]()
(2)![]()
![]()
![]()