08届高考化学物质的量检测试卷
相对原子质量:H—1 C—12 Na—23 O—16 P—31 Si—28 S—32 Cu—64
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试题卷上。
4.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第I卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
1.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4 D.压强相同,体积相同的O2和H2
2.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1.8g铵根离子所含的电子数为1.1NA B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,
则阴极析出的气体的分子数为0.5NA
3.(2007年高考上海化学卷,物质的量)下列有关物理量相应的单位表达错误的是( )
A.摩尔质量g/mol B.气体摩尔体积L/mol C.溶解度g/100g D.密度g/cm3
4.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.化学反应![]()
![]()
![]() 是一个可逆反应。在持续加热的条件下,向密闭容器中充入2molH2和3molI2蒸气,充分反应后,该密闭容器内( )
是一个可逆反应。在持续加热的条件下,向密闭容器中充入2molH2和3molI2蒸气,充分反应后,该密闭容器内( )
A.![]() 已耗尽 B.
已耗尽 B.![]() 已耗尽 C.HI的物质的量少于4mol D.HI的物质的量等于4mol
已耗尽 C.HI的物质的量少于4mol D.HI的物质的量等于4mol
6.在273K和101k Pa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是( )
A.6.72L B.7.84L C.10.08L D.13.44L
7.(2007年高考理综四川卷,NA)用NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
B.7 g CnH2n中含有的氢原子数目为NA C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5 mol/L Na2CO3溶液中含有的CO32 -数目为0.5NA
8.(2007年高考海南化学卷,阿伏加德罗定律)下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
9.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和![]() ,②
,②![]() 和
和![]() ,③
,③![]() 和
和![]() .现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为
.现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为![]() 、
、![]() 、
、![]() ,则下列关系正确的是( )
,则下列关系正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10.已知 Q 与 R 的摩尔质量之比为 9:22 .在反应 X + 2Y = 2Q + R 中,当 1.6g X与 Y 完全反应后,生成 4.4gR , 则参与反应的 Y 和生成物 Q 的质量之比为( )
A.46:9 B.32:9 C.23:9 D.16:9
11.4%的![]() 溶液
溶液![]() 的密度为
的密度为![]() ,36%的
,36%的![]() 溶液
溶液![]() 的密度为
的密度为![]() ,若将上述两溶液等体积混合,所得
,若将上述两溶液等体积混合,所得![]() 溶液中溶质的质量分数是( )
溶液中溶质的质量分数是( )
A.等于20% B.大于20% C.小于20% D.无法估算
12.在100mL溶有1.70gAgNO3的溶液中加入100mL![]() 的
的![]() 溶液,再加入
溶液,再加入![]() 溶有
溶有![]() 的溶液,充分反应。下列说法中正确的是( )
的溶液,充分反应。下列说法中正确的是( )
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中,![]() 的物质的量浓度为
的物质的量浓度为![]()
D. 在最终得到的溶液中,![]() 的物质的量为
的物质的量为![]()
13.下列实验中,①配制—定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发 ⑤溶解,均用到的仪器是( )
A.烧杯 B.漏斗 C.玻璃棒 D.胶头滴管
14.若以![]() 和
和![]() 分别表示浓度为
分别表示浓度为![]() 和
和![]() 氨水的质量分数,且知2a=b,则
氨水的质量分数,且知2a=b,则
下列推断正确的是(氨水的密度比纯水的小)( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.(2007年高考海南化学卷,物质的量浓度)有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
16.下列叙述正确的是( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
17.(2007年高考理综宁夏卷,物质的量)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为( )
A.1:7 B.7:1 C.7:8 D.8:7
18.以![]() 表示阿伏加德罗常数,下列说法中正确的是( )
表示阿伏加德罗常数,下列说法中正确的是( )
A.53g碳酸钠中含![]() 个
个![]() B.0.1mol
B.0.1mol![]() 含
含![]() 个电子
个电子
C.1.8g重水(![]() )中含
)中含![]() 个中子 D.标准状况下11.2L臭氧中含
个中子 D.标准状况下11.2L臭氧中含![]() 个氧原子
个氧原子
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
 长葛三高2007-2008学年高考总复习单元检测试卷
长葛三高2007-2008学年高考总复习单元检测试卷
高三化学(物质的量)
选择题答题表:
一、选择题:(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第II卷(非选择题,共46分)
二、填空题:(本题包括4小题,共39分)
19.(21分)(Ⅰ).(4分)下面是化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
(1)其中标示出仪器使用温度的是_____________(填写编号);
(2)实验时用来精确量取液体体积的是__________(填写编号);
(3)使用前要检查仪器是否漏液的是____________________(填写编号);
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为____g。
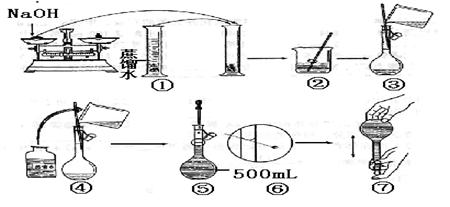
(9分)(Ⅱ).实验室配制500mL0.1mol/L Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为 (同一步骤可用多次)
A调整零点 B将游码移至刻度尺的零刻度处 C将碳酸钠晶体放入小烧杯中称量
D称量空的小烧杯 E将砝码放回砝码盒内 F记录称量的结果
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、 、 ,
(4)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
A加水时超过刻度线 B忘记将洗涤液加入容量瓶
C 容量瓶内壁附有水珠而未干燥处理 D定容后摇匀液面低于刻度线
(8分)(Ⅲ).实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号): .
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?答:
20.(6分)某学生用已知质量yg的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示),下面他的操作应该是 使 。
若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mol·L-1NaOH溶液过程示意图中有错误的是(填操作序号) 。
|
21.(6分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
22.(6分)混合物平均摩尔质量通常可表示为:![]() ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
⑴相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是: ;
⑵在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)![]() CO(g)+H2 (g);假如温度保持不变并加压,则
CO(g)+H2 (g);假如温度保持不变并加压,则![]() (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”);
三、计算题:(本题包括2小题,共7分)
23.(3分)在10mL硫酸和硫酸钾的混合溶液中,硫酸的物质的量浓度为1.6mol/L,硫酸钾的物质的量浓度为3.0mol/L。欲使硫酸的浓度变为2.0mol/L,硫酸钾的浓度变为0.30mol/L,现用98%的浓硫酸(ρ=1.84 g·cm—3)和蒸馏水进行配制。试求需要取用浓硫酸的体积。
24.(4分)氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。
(1)将标准状况下11.2L氨气溶于100mL水中,得到密度为0.868g·cm-3的氨水。求所得氨水的物质的量浓度。
(2)将上述30mL氨水与70mL2mol·L-1的AlCl3溶液混合,生成的沉淀质量为ag,求a的值。
高三化学(物质的量)参考答案及评分建议
一、选择题:(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | C | A | C | D | B | B | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | B | B | C | C | D | B | B | B |
二、填空题:(本题包括4小题,共39分)
19.(21分)(Ⅰ).(4分)⑴abc ⑵c ⑶bc ⑷9.5 (每空1分)
(9分)(Ⅱ).(1)14.3 (2)BADFCFEB (3)500mL容量瓶、玻璃棒、胶头滴管 (4)偏低、偏低、不变、不变 (每空1分)
(8分)(Ⅲ).(1)100mL (2)②④⑥⑧ (3)ABCD (4)将容量瓶中的溶液倒出并洗涤干净后,再重新配制。 (每空2分)
20.(6分)继续加入样品 指针指在标尺的中间 ①③⑥; (每空2分)
21.(6分)(1)3NH3+3Cl2 6NH4Cl+N2
(2)3:2
(3)![]() (每空2分)
(每空2分)
22.(6分)⑴
<; 因为![]() (空气)=29g/mol,M(H2O)=18g/mol,则
(空气)=29g/mol,M(H2O)=18g/mol,则![]() (总)必小于29g/mol;⑵变大; (每空2分)
(总)必小于29g/mol;⑵变大; (每空2分)
三、计算题:(本题包括2小题,共7分)
23.(3分)根据K2SO4守恒,可求得最后溶液的体积:
V(aq)=0.01L×3.0mol·L-1/0.30mol·L-1=0.10L 最后溶液中n(H2SO4)=0.10L×2.0mol·L-1=0.20mol
原溶液中n(H2SO4)=0.01L×1.6mol·L-1=0.016mol 需加入n(H2SO4)=0.20mol-0.016mol=0.184mol
则加入98%浓硫酸体积为:V[H2SO4(aq)]=0.184mol×98g·mol-1/98%×1.84g·L-1=10.0m L
答:应向原溶液中加入98%的浓硫酸10mL,再加水将溶液稀释至100m L.
24.(4分)(1)所得氨水的物质的量浓度为:
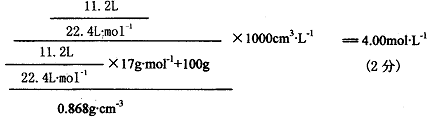 |
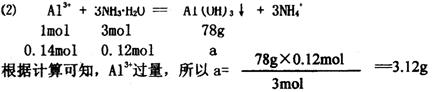 |