高考化学选择易错1
1.下列说法正确的是
A.阴阳离子间的通过相互吸引而形成离子键
B.含有非极性键的分子都不是极性分子
C.化学键只存在于分子内、原子间
D.原子晶体中一种或几种原子通过共价键形成立体网状结构
2.下列反应的离子方程式错误的是
A.NH4HSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32—+H2O=2NaHCO3↓
D.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
3.某含有Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向“①”中所得溶液中加入BaCl2溶液,无沉淀生成;③向“①”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液
A.一定存在Fe2+、Br-、CO32- B.一定呈碱性
C.一定不存在I-、SO32- D.可能存在NH4+
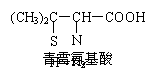 4.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与—OH具有类似性质)。下列关于青霉氨基酸的推断合理的是
4.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中的-SH与—OH具有类似性质)。下列关于青霉氨基酸的推断合理的是
A.青霉氨基酸分子中所有碳原子均在同一直线上
B.青霉氨基酸具有两性并能发生酯化反应
C.青霉氨基酸分子间能形成多肽
D.1mol青霉氨基酸与足量的金属钠反应生成0.5mol H2
5.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。下列关于固体燃料电池的有关说法正确的是
A.通O2的电极为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
6.下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
7.常温下,物质的量浓度均为0.1mol·L-1的两溶液HA、BOH。其中HA溶液的pH>1,BOH溶液中c(OH-)/c(H+)=1012,则下列有关说法正确的是
A.HA溶液中水的电离程度大于BOH溶液中水的电离程度
B.将HA、BOH溶液稀释相同的倍数,pH值变化前者大于后者
C.若两溶液混合时:V(BOH)≥V(HA) ,则必有混合液中c(B+)>c(A-)
D.将HA、BOH混合所得pH=7的溶液中必有c(B+)=c(HA)+c(A-)
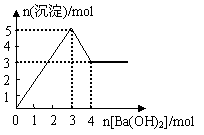 8.右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
8.右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A.MgSO4 B.KAl(SO4)2
C.Al2(SO4)3 D.NaAlO2
9.在乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是(说明:在实验过程中不允许加热、过滤、等操作)
| 选 项 | 试 剂 丙 | 甲 离 子 | 乙 离 子 |
| A | 稀盐酸、BaCl2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | SO42- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | NaOH溶液 | Al3+ | Mg2+ |
10.已知热化学方程式2SO2(g)+ O2(g)![]() 2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是
2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是
A.2molSO2(g)和1mol O2(g)所具有的能量大于2 molSO3(g)所具有的能量
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量
C.升高温度,平衡向逆反应移动,上述热化学方程式中的Q值将减小
D.如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化
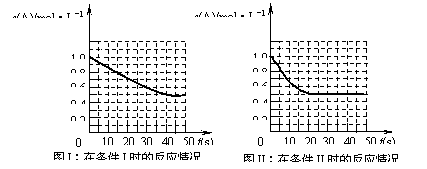
![]() 11.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
11.在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
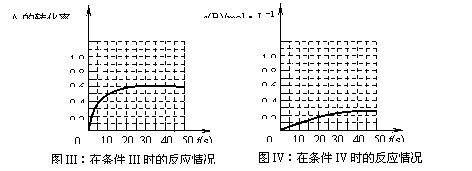 |
下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能增大了反应体系的压强
12.将KCl和CrCl3两种固体混合物共熔发生化合反应制得化合物X。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可与过量的KI发生氧化还原反应氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
13.有一根粗铝含铁和硅两种杂质,取等质量的粗铝分别投入到足量的稀HCl和足量的 NaOH溶液中,放出等量的H2,则该粗铝中,铁和硅的关系为①物质的量之比为2:1 ②物质的量之比为3:1 ③质量之比为2:1 ④质量之比为4:1
A.①③ B.①④ C.②③ D.②④
14.下列物质中既能跟H2S反应,又能使溴水褪色的是 ①K2S溶液 ②SO2 ③CuSO4溶液 ④AgNO3溶液 ⑤氯化亚铁溶液 ⑥烧碱溶液
A.①②③ B.①②④⑥ C.③④⑤⑥ D.②④⑥
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),
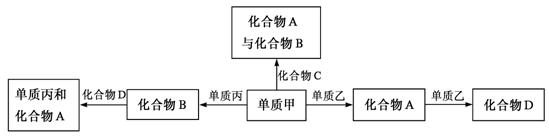 |
以下结论不正确的是
A.甲、乙、丙三种单质的晶体均是分子晶体
B.上述转化关系所涉及的化合物中有一种是电解质
C.上图所示的五个转化关系中,有三个是化合反应
D.上图所示的五个转化关系中,均为放热反应
16.根据元素周期表和一些已有化学知识可推测另一些物质的性质,下列推断合理的是
A.硫酸锶的溶解度大于硫酸钡的溶解度、氢氧化锶的溶解度大于氢氧化钡的溶解度
B.氯气在有机溶剂(如汽油、CCl4)中的溶解度大于在水中的
C.位于ⅠA和ⅦA族中间的碳族单质的熔点应是先逐渐增高后逐渐降低
D.碳酸钾的分解温度高于碳酸钠
17.工业生产苯乙烯是利用乙苯的脱氢反应:
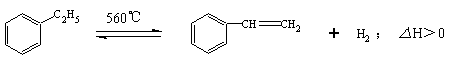
针对上述反应,有人提出如下观点,其中合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
18.今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L
19.含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.NaOH和Na2S B.Na2S和NaHS C.NaHS D.Na2S
20.一定条件下将质量为Xg的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Yg,下列对应关系一定不正确的是
| 序号 | 有机物 | X | Y |
| A | C2H4和C3H6的混合物 | m | 15m/7 |
| B | HCOOH | m | m |
| C | CH3OH 和CH3COOH的混合物 | m | m |
| D | CH3COOCH3 | m | 45m/37 |