湄池中学高三理科综合模拟考试
试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分300分,考试时间150分钟。
第I卷(选择题共132分)
本卷共22题。在下列各题的四个选项中,只有一个选项是符合题目要求的。
1、关于人体新陈代谢的说法,正确的是
A.一切营养物质都要经过消化才能被人体吸收
B.一切营养物质都要经过内环境才能被体内细胞吸收
C.各种代谢终产物都须经过泌尿系统排出体外
D.只有当合成代谢大于分解代谢时,生命才能存在
2、下列实验中,必须始终用活细胞做材料的实验是
①观察细胞的有丝分裂过程 ②观察植物细胞的质壁分离及复原
③观察根对矿质元素离子的交换吸附现象 ④叶绿体中色素
 A.①②
B.②③ C.③④ D.④①
A.①②
B.②③ C.③④ D.④①
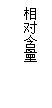
3、在某一时刻测定一器官的动脉和静脉血液内三种物质的含量,其相对数值如图所示,该器官是
A.肺 B.脑 C.肌肉 D.小肠
 4、豌豆种子萌发过程中的吸水过程分为Ⅰ、Ⅱ、Ⅲ一个阶段,三个阶段吸水的特点如图所示。科学家研究发现,在第Ⅱ阶段种子O2的吸收量大大低于CO2的释放量,而在第Ⅲ阶段O2的吸收就显著增加。下列有关种子萌发初期生理变化的说法错误的是
4、豌豆种子萌发过程中的吸水过程分为Ⅰ、Ⅱ、Ⅲ一个阶段,三个阶段吸水的特点如图所示。科学家研究发现,在第Ⅱ阶段种子O2的吸收量大大低于CO2的释放量,而在第Ⅲ阶段O2的吸收就显著增加。下列有关种子萌发初期生理变化的说法错误的是
A.第Ⅰ阶段吸水与蛋白质、淀粉等物质有关
B.第Ⅱ阶段呼吸作用强度最弱
C.第Ⅱ阶段吸水缓慢或基本停止
D.第Ⅰ阶段的干重最重
5、肾小管与其周围毛细血管之间水分的交换是通过渗透作用完成的。如果流经肾小管的原尿中葡萄糖浓度明显增高并且不能完全被肾小管重吸收,那么最终排出的尿液量将会
A.增加 B.减少 C.不变 D.不确定
6、生活中的一些问题常涉及到化学知识,下列叙述中正确的是
①使用明矾可软化硬水;②硫酸钡难溶于水和酸,可做X光透视肠胃的药剂;③铁制品在干燥的空气中容易生锈;④医疗中消毒用的是体积分数为75%的酒精;⑤棉花、蚕丝和人造毛的主要成分都是纤维素;⑥福尔马林是混合物,可用来制作生物标本
A.①②③ B.④⑤⑥ C.①③⑤ D.②④⑥
7、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH C.NaAlO2和H2SO4 D.H2SO4和Na2CO3
8、设NA为阿伏加德罗常数,下列叙述中正确的是
A.在标准状况下,体积为5.6 L的三氧化硫中含有的原子数为NA
B.常温常压下,1 mol氦气含有的原子数为NA
C.从四氧化三铁中还原出1 mol铁,发生转移的电子数为3NA
D.1 mol碳正离子(CH![]() )所含的电子数为10 NA
)所含的电子数为10 NA
9、剧毒物砒霜的化学名称为三氧化二砷。下列关于砷的说法错误的是
A.砷原子核外最外层电子数为5 B.砷的氢化物不如PH3稳定
C.砷酸的化学式为H3AsO4 D.砷是一种金属
10、我国研制的磁谱仪已利用航空器送入太空,其目的是探索反物质的存在。则以下可表示反物质酸和反物质碱进行中和反应的实质的离子方程式是
A.H-+OH+=H2O B.H++OH+=H2O
C.H-+OH-=H2O D.H++OH-=H2O
11、右图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
|
B.C为VA族元素
C.三种元素都为金属元素
D.C是化学性质最活泼的非金属
12、用普通食盐进行电解饱和食盐水的实验,食盐水装在U形管内。结果很快在某一电极附近出现食盐水浑浊现象。造成浑浊的难溶物主要是
A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡

![]() 13、今有反应X(气)+Y(气) 2Z(气)+Q右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
13、今有反应X(气)+Y(气) 2Z(气)+Q右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
A.升高温度或降低Y的浓度
B.加入催化剂或增大X的浓度
C.降低温度或增大Y的浓度
D.缩小体积或降低X的浓度
14、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是
A. 水由液态变为玻璃态,体积缩小 B. 水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态 D. 玻璃态水是分子晶体
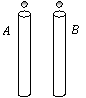 15、如图所示,A、B为大小、形状均相同且内壁光滑,但用不同材料制成的圆管,竖直固定在相同高度,两个相同的磁性小球,同时从A、B管上端的管口无初速释放,穿过A管的小球比穿过B管的小球先落到地面,下面对于两管的描述中可能正确的是:
15、如图所示,A、B为大小、形状均相同且内壁光滑,但用不同材料制成的圆管,竖直固定在相同高度,两个相同的磁性小球,同时从A、B管上端的管口无初速释放,穿过A管的小球比穿过B管的小球先落到地面,下面对于两管的描述中可能正确的是:
A、A管是用铜制成的,B管是用塑料制成的。
B、A管是用橡胶制成的,B管是用胶木制成的。
C、A管是用胶木制成的,B管是用塑料制成的。
D、A管是用陶瓷制成的,B管是用铝制成的。
16、一航天探测器完成对月球的探测任务后,在离开月球的过程中,由静止开始沿着与月球表面成一倾斜角的直线飞行,先加速运动,再匀速运动,探测器通过喷气而获得推动力。以下关于喷气方面的描述中正确的是:
A、探测器加速运动时,沿直线向后喷气 B、探测器加速运动时,竖直向下喷气
C、探测器匀速运动时,竖直向下喷气 D、探测器匀速运动时,不需要喷气
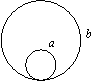 17、两个相同的带电金属小球,相距r(r远大于小球的半径)放置时,它们之间静电力的大小为F。现让两球相互接触后放原处,若它们之间的静电力的大小仍为F,则两球相互接触前的带电情况可能是:
17、两个相同的带电金属小球,相距r(r远大于小球的半径)放置时,它们之间静电力的大小为F。现让两球相互接触后放原处,若它们之间的静电力的大小仍为F,则两球相互接触前的带电情况可能是:
A、一定带有等量同种电荷 B、可能带有不等量的同种电荷
C、可能带有不等量的异种电荷 D、条件不足不能确定
18、在匀强磁场中,一个原来静止的原子核发生衰变得到如所示的径迹,则下列说法中正确的是:
A、发生的是β衰变,b为β粒子的径迹
B、发生的是β衰变,a为β粒子的径迹
C、发生的是α衰变,a为α粒子的径迹
D、发生的是α衰变,b为α粒子的径迹
19、一块透明的玻璃片,表面粘有很薄的油膜,阳光照射时,发现玻璃照射面上看到彩色图样,在玻璃片的边缘也看到彩色图样。这两者:
A、都是干涉现象 B、都是衍射现象
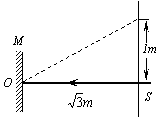 C、前者是干涉现象,后者是色散现象 D、前者是增透现象,后者是衍射现象
C、前者是干涉现象,后者是色散现象 D、前者是增透现象,后者是衍射现象
20、如图所示,从光源S发出的光垂直照射到平面镜M上,经反射在正对着平面镜![]() m处的墙上有一光斑,若要使光斑向上移动1m,平面镜应以O点为轴转过的角度是:
m处的墙上有一光斑,若要使光斑向上移动1m,平面镜应以O点为轴转过的角度是:
A、150 B、300 C、450 D、600
 |
 21、如图所示的演示装置,一根张紧的水平绳上挂着五个单摆,其中A、E摆长相同,先使A摆摆动,其余各摆也摆动起来,可以发现:
21、如图所示的演示装置,一根张紧的水平绳上挂着五个单摆,其中A、E摆长相同,先使A摆摆动,其余各摆也摆动起来,可以发现:
A、各摆摆动的周期均与A摆相同
B、B摆摆动的周期最短
C、C摆振幅最大
D、C摆摆动周期最长
22、如图,物体A静止在水平地面上,下面说法正确的是:
A、物体对地面的压力和它受到的重力,大小相等,所以这是一对平衡力。
![]() B、物体对地面的压力和它受到的重力,大小相等,所以这是一对作用力和反作用力。
B、物体对地面的压力和它受到的重力,大小相等,所以这是一对作用力和反作用力。
C、物体对地面的压力和地面对物体的支持力是一对作用力和反作用力。
D、物体受到的重力和地面对它的支持力是一对作用力和反作用力。
第II卷(非选择题 共168分)
本卷共12道题。
以下数据可供解题时参考:
相对原子质量:H 1,C 12,O 16,Cl 35.5,Ca 40,Co 59。
23.(10分)现有一种植物的种子,已经知道它的萌发受水分、温度和氧气的影响,但不了解其萌发与光是否有关,探究光的有无对该种子萌发的影响,请你依据所给材料和用品设计出实验的方法步骤,预测可能的实验结果,并分别得出相应的结论。
(一)材料和用品:数量充足的铺有滤纸的培养皿、无菌水、表面消毒过的种子等
(二)方法步骤:
①
②
(三)实验结果及相应的结论:
①
②
③
24、(20分)以下是研究性学习的2个课题:
(1)科学研究发现,人们长期接触这种除草剂患某种癌症的可能性要远远高于未接触者。美国科学家从一种细菌的DNA中分离得到了能降解2,4-D除草剂的基因片段,将其转移到另一种细菌细胞内,获得了能高效降解2,4-D除草剂的转基因菌。据此回答:
①2,4-D既能促进双子叶植物生长又能杀死双子叶植物的原因是 。
②该转基因菌能表现也降解2,4-D的性状并能代代相传,所遵循的生物学原理是 。
③人们在生产上不直接应用最早发现的具有降解基因的细菌,而是培育和应用转基因菌来降解除草剂的可能原因是,转基因菌与原细菌相比有如下特点: 。
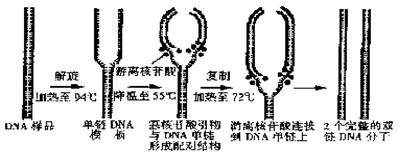
(2)资料显示,近10年来,PCR技术(聚合酶链反应)成为分子生物学实验室的一种常规实验手段,其原理是利用DNA半保留复制的特性,在试管中进行DNA的人工复制(如下图),在很短的时间内,将DNA扩增几百万倍甚至几十亿倍,使实验室所需的遗传物质不再受限于活的生物体。请据图回答:
①加热至94℃的目的是使DNA中的___键断裂,这一过程在细胞内是通过_____的作用来完成的。
②综合PCR技术与人体细胞内DNA合成过程可知,二者的必需条件中,除了模板、原料、ATP、酶以外,至少还有3个是______________________________。
③PCR技术不仅为遗传病的诊断带来了便利,而且改进了检测细菌和病毒的方法。若要检测一个人是否感染了艾滋病毒,你认为可用PCR技术扩增他血液中的
A.白细胞DNA B.病毒的蛋白质 C.血浆中的抗体 D.病毒的核酸
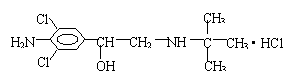 25、《化学教育》第十期报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为:
25、《化学教育》第十期报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为:
(1)其分子式为_____________________。
(2)它不可能发生的反应为___________。
A.水解反应 B.加成反应 C.与钠反应放出氢气 D.加聚反应
(3)从结构上分析,该物质可看作_________类物质。
A.芳香族化合物 B.醇 C.卤代烃 D.氨基酸
26、甲、乙是二种常见的短周期元素的单质,它们的性质如下图。其中C为白色沉淀,D为气体。
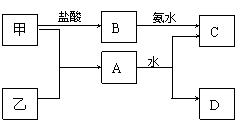 (1)若D为酸性气体,则A的化学式为___。
(1)若D为酸性气体,则A的化学式为___。
(2)若D为碱性气体,则A+H2O→C+D的化学方程式为_____________。此时生成1mol气体D,同时得到____mol沉淀C。
(3)若由2种元素组成的化合物M发生水解,只生成2种酸X和Y,下下列说法中正确的是____________(填序号)。
①M可能由两种非金属组成
②X、Y一定为一元酸 ③M一定含有金属元素
④此反应可能为氧化还原反应 ⑤生成物中无氧酸,含氧酸并存。
![]() 27、高炉炼铁中发生的基本反应如下:FeO(s)+CO(g) Fe(s)+CO2(g)―Q。其平衡常数可表达为:K=c(CO2)/c(CO),已知1100℃,K=0.263
27、高炉炼铁中发生的基本反应如下:FeO(s)+CO(g) Fe(s)+CO2(g)―Q。其平衡常数可表达为:K=c(CO2)/c(CO),已知1100℃,K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值________,平衡常数K值________(本小题空格填“增大”“减小”或“不变”)
(2)1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_________(填“是”或“否”),此时化学反应速率是V正 ______V逆(填“大于”、“小于”或“等于”),其原因是_________________。
28、密闭容器内装入某混合气体,用电火花点燃,恰好完全反应。已知混合气体可能由H2、CO、O2中的两种气体或三种气体混合而成。
(1)若混合气体中只含有H2 、O2两种气体,则其中H2分子与O2分子的个数之比为______。
(2)若混合气体中只含有CO、O2两种气体,则其中CO分子与O2分子的个数之比为______。
(3)若混合气体中同时含有H2 、CO 、O2三种气体,且总质量为62g,其中氧气的质量为32g,则H2 、CO 、O2三者的质量之比为________。
(4)若混合气体由有H2、CO、O2三种气体组成,则此三种气体的分子数之间应满足的条件是(用VH2、VCO、VO2表示)_________。
29、用50mL NaOH溶液吸收CO2气体制备Na2CO3。为防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:(i)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ii)小心煮沸溶液1~2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
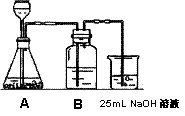 (1)他能否制得较纯净的Na2CO3? ____ 。理由是 ___ 。
(1)他能否制得较纯净的Na2CO3? ____ 。理由是 ___ 。
(2)按他的设计,第(i)步实验装置如图1:
① 装置A使用的试剂是石灰石和盐酸溶液。可否使用纯碱代替石灰石? ___ 。原因是 ___ 。
② 装置B使用的试剂是 ___ ,作用是 ___ 。
③ 为了后续的煮沸、混合等实验,装NaOH溶液的容器还可使用 ___ 。(填实验仪器)
④ 有人认为实验步骤(ii)、(iii)的顺序对调,即先混合,再煮沸,更合理,你认为对吗? ___ ,为什么? ___ 。
 30、如图所示是光滑斜面上由静止开始自由下滑的小球的闪光照相,闪光频率是10Hz,图中AB=2.4cm,BC=7.3cm,CD=12.2cm,DE=17.1cm,据此估算斜面的倾角多大?
30、如图所示是光滑斜面上由静止开始自由下滑的小球的闪光照相,闪光频率是10Hz,图中AB=2.4cm,BC=7.3cm,CD=12.2cm,DE=17.1cm,据此估算斜面的倾角多大?
![]()
![]()
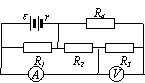 31、如图所示,电源电动势ε=8V,内阻r=0.5Ω,电阻R2=18Ω,R3=10Ω,电路接通后,电流表A示数为1.0A,电压表V示数为6.0V,求:
31、如图所示,电源电动势ε=8V,内阻r=0.5Ω,电阻R2=18Ω,R3=10Ω,电路接通后,电流表A示数为1.0A,电压表V示数为6.0V,求:
(1)电阻R1、R4的阻值各是多大?
(2)电源的输出功率是多少?
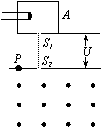 32、如图所示,为测量某种离子的荷质比的装置,让中性气体分子进入电离室A,在那里被电离成离子,这些离子从电离室的小孔飘出,从缝S1进入加速电场加速,然后让离子从缝S2垂直进入匀强磁场,最后打在底片上的P点。已知加速电压为U,磁场的磁感应强度为B,缝S2与P之间的距离为a,离子进入缝S1时的速度不计,求该离子的荷质比
32、如图所示,为测量某种离子的荷质比的装置,让中性气体分子进入电离室A,在那里被电离成离子,这些离子从电离室的小孔飘出,从缝S1进入加速电场加速,然后让离子从缝S2垂直进入匀强磁场,最后打在底片上的P点。已知加速电压为U,磁场的磁感应强度为B,缝S2与P之间的距离为a,离子进入缝S1时的速度不计,求该离子的荷质比![]() 。
。
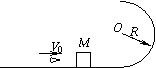 33、如图,光滑轨道竖直放置,半圆部分的半径为R,在水平轨道上停放着一个质量为M=0.99kg的木块,一颗质量为m=0.01kg的子弹,以V0=800m/s的水平速度射入木块中,然后一起运动到轨道最高点水平抛出,试分析:当圆半径R多大时,平抛的水平位移最大?且最大值为多少?(g=10m/s2)
33、如图,光滑轨道竖直放置,半圆部分的半径为R,在水平轨道上停放着一个质量为M=0.99kg的木块,一颗质量为m=0.01kg的子弹,以V0=800m/s的水平速度射入木块中,然后一起运动到轨道最高点水平抛出,试分析:当圆半径R多大时,平抛的水平位移最大?且最大值为多少?(g=10m/s2)
高三理科综合答题卷

选择题 | 总分 | ||||||
| 物理 | |||||||
| 化学 | |||||||
| 生物 |
一、选择题:(每小题只有一个正确答案,每小题6分,共132分,)
| 题号 | 1 | 2 | 3 | 4 | 5 | ||||
| 答案 | |||||||||
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | |||||||||
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | |
| 答案 | |||||||||
二、非选择题:(共168分)
23、(10分)
(二)①
②
(三)①
②
③
24、(20分)
(1)①
②
③
(2)① 键 。
② 。
③
25、(12分)
(1)分子式: 。
(2) 。
(3) 。
26、(12分)
(1)化学式: 。
(2)化学方程式 。 mol。
(3)(填写序号) 。
27、(10分)
(1)比值: ;K值: 。
(2) ;V正 V逆。
原因: 。
28、(14分)
(1) 。(2) 。(3) 。
(4) 。
29、(18分)
(1) 。理由: 。
(2)① 。原因: 。
② 。原因: 。
③ 。
④ , 。
30、(14分)
31、(20分)
 32、(18分)
32、(18分)
33、(20分)