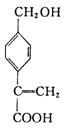
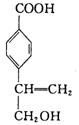
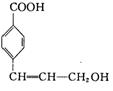
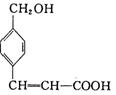
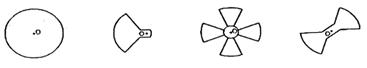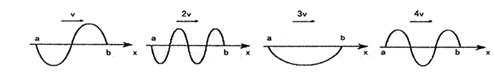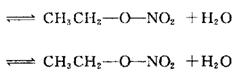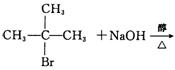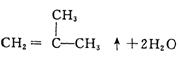高三理科综合一诊适应性试题
班级: 姓名: 总分:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
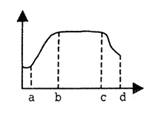
|
|
|
|
|
|
|
|
|
|
|
|
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅰ卷(选择题,共132分)
以下数据可供解题时参考:
相对原子质量:H—1 S—32 O—16 Fe—56 Na—23
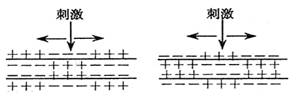
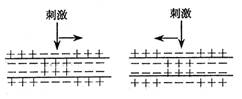
1.在一条离体神经纤维的中段施加电刺激,使其兴奋。下列各图表示刺激时的膜内外电位
|
|
A. B. C. D.
2.有关生态学问题的叙述中不正确的是 ( )
A.大力植树造林,改善能源结构,是缓解“温室效应”的最佳途径
B.生物圈具有多层次的自我调节能力,其基础是生物的多样性
C.抵抗力、稳定性高的生态系统,恢复力、稳定性往往比较低
D.被有机物轻度污染的流动水体中,距排污口越近的水体中溶解氧越多
|
A.该坐标可用来表示叶片年龄与其叶绿素含量的关系
B.该坐标可用来表示叶片年龄与单位时间内光合作用
月产量(条件适宜)
C.该坐示可用来表示叶片年龄与叶片中钙含量的关系
D.若表示一个国家人口数量随时间变化时,在a—b段该国老年人数量比例较小
4.光照下正常生长的某绿色植物,其他条件不变,突然停止光照。请判断短时间内叶绿体
中C3合成速率 ( )
A.加快 B.减慢 C.不变 D.先加快后减慢
5.用含有各种14需元素的溶液培养大麦。实验分两组,一组在光下,一组在黑暗中,48小
时后测定几种离子的浓度。表中各离子下的数据为实验结束时,溶液中离子的浓度占实
验开始时浓度的百分比。
| 实验条件 | 水分消耗(ml) | Ca2+ K+ Mg2+(%) |
| 光下 | 1090 | 135 27 179 |
| 暗中 | 435 | 105 35 113 |
不能得出的结论是 ( )
A.光下蒸腾作用比暗中强,消耗水分多 B.吸收矿元素离子与呼吸作用关系密切
C.吸收水分和吸收矿质元素是两个相对独立的过程D.植物对矿质离子的吸收具有选择性
6.有关生物进化的说法不正确的是 ( )
A.生物进化的实质在于种群基因频离的改变B.自然选择使种群的基因频率发生定向改变
C.隔离在物种形成中的主要作用是使种群之间停止基因交流
D.新物种形成的标志是改变了基因频率
7.下列关于实验现象的描述正确的是 ( )
A.向盛有葡萄糖溶液的试管中加入斐林试剂,产生砖红色沉淀
B.DNA的粗提取实验中,第二次加入蒸馏水并搅拌,能析出含DNA的黏稠物
C.同一叶片受SO2危害的顺序是先叶柄后叶片
D.纸层析法分离叶绿体中的色素,滤纸上最宽的色素带是黄绿色
8.下列物质只含离子键的是 ( )
A.NaOH B.Mg3N2 C.HCl D.CaC2
9.ClO2是一种广谱型消毒剂,根据世界环保联盟的要求ClO2将逐渐代替Cl2成为生产自来
水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,
在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A.1:1 B.1:2 C.2:1 D.2:3
10.下列操作中错误的是 ( )
A.除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
C.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入Fe粉,过滤
11.能够使反应Cu+2H2O=Cu(OH)2↓+H2↑发生的是 ( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠水溶液D.用铜片作阴、阳电极,电解硫酸铜水溶液
12.室温下,已知某溶液中由水电离产生的H+和OH—的物质的量浓度的乘积为10—24,则在该溶液中,一定不能大量存在的离子是: ( )
A.S2O32— B.NH4+ C.NO3— D.HCO3—
13.下列离子方程式正确的是 ( )
A.铁投入过量稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B.醋酸和氨水的反应:CH3COOH+NH3·H2O=CH3COO—+NH4++H2O
C.铁和氯化铁溶液的反应:Fe+Fe3+=2Fe2+ D.把金属钠投入水中:Na+2H2O=Na++2OH—+H2↑
14.下列各组混合物,不管它们以任何比例混合,只要总质量固定,完全燃烧后所得的CO2
的量为常量,则该组有机物为 ( )
A.甲醛和乙酸 B.丁烯和丁烷 C.甲醇和乙醇 D.乙醇和乙醚
15.在15gFe和Fe2O3的混合物中,加入稀硫酸200mL,放出标准状况下的H21.68L,反应停止后,溶液中无Fe3+.为中和过量的硫酸,并使Fe2+完全转化为Fe(OH)2沉淀,共用去3mol·L—1NaOH溶液200mL,则稀硫酸的物质的量浓度为 ( )
A.6.0mol·L—1 B.3.0 mol·L—1 C.1.5 mol·L—1 D.1.0 mol·L—1
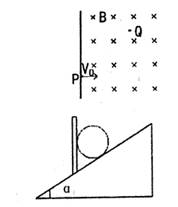
|
P沿垂直于磁场的方向射入磁场,则它们中能到
达图中Q点的粒子带电情况(重力不计)( )
A.一定带正电 B.一定带负电
C.可能不带电 D.不论带正电还是负电都有可能
17.如图所示,在倾角为α的斜面上放置一质量为m的小球,小球被
竖直的挡板挡住,不计一切摩擦,则平衡时小球对斜面的压力为( )
A.mgcosα B.mgtgα
C.![]() D.
D.![]()
18.在恒温水池中,一个气泡缓缓上浮,若忽略气泡内气体分子间势能的变化,则在气泡上升过程
A.气泡的内能减少,外界对气泡做功,放出热量B.气泡的内能不变,不放出热量也不吸收热量
C.气泡的内能不变,对外做功,吸收热量 D.气泡的内能增加,吸收热量
19.手机是现代人们常用通信工具,当来电话时,可以用振动来提示人们。其实振动原理很简单:用一个微型电动机带动转轴上的叶片转动。当叶片转动后,手机就跟着振动起来。其中叶片的形状你认为下图的哪种最为合理(O为垂直于纸面的转轴) ( )
|
A. B. C. D.
20.关于爱因斯坦质能方程,有下列几种理解:①质量为m的煤,完全燃烧放出的能量为mc2;②质量为m的物体,具有的能量为mc2;③α粒子的质量为m,因此在α衰变中放出的能量为mc2;④核反应中若质量亏损为m,则该反应中释放的核能为mc2。其中正确的是
A.只有② B.只有④ C.①③ D.②④
21.一台普通交流发电机在工作时产生的感应电动势为![]() ,若将电枢线圈的转速提高1倍,则其电动势将变为 ( )
,若将电枢线圈的转速提高1倍,则其电动势将变为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
22.如图所示,有四列简谐波同时沿x轴正方向传播,波速分别是v、2v、3v和4v,a、b是x轴上所给定的两点,且ab=d,在t时刻a、b两点间四列波的波形分别如图所示,则由该时刻起a点出现波峰最快的图是 ( )
|
A. B. C. D.
第Ⅱ卷(非选择题,共168分)
23.Ⅰ(17分)某同学在用单摆测定重力加速度的实验中,测出了几组周期T和摆长L的值,经数据处理后填在下表中
| 次数 | 1 | 2 | 3 | 4 | 5 |
| L(m) | 0.5000 | 0.8000 | 0.9000 | 1.0000 | 1.2000 |
| T(s) | 1.42 | 1.89 | 1.90 | 2.00 | 2.20 |
| T2(S2) | 2.02 | 3.57 | 3.61 | 4.00 | 4.84 |
|
作出合理的图象;(取![]() )
)
(2)由所作图象求得重力加速度为 m/s2.
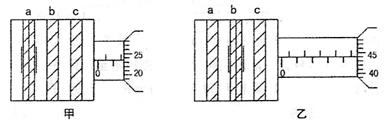
Ⅱ在用双缝干涉现象测光的波长的实验中,准备了下列仪器:
A. 白炽灯 B.双窄缝片 C.单窄缝片D.滤色片毛玻璃光屏
(1)把以上仪器安装在光具座上,合理的顺序是 (填字母)。
(2)在某次实验中,用某种单色光通过双缝在光屏上得到明暗相间的干涉条纹,其中
相邻两条亮纹a、b的位置可利用测量头上的分划板确定,如图所示。其中表示a
|
(3)如果上述实验中双缝与光屏间距为1m,所用的双窄缝片是相距0.18mm规格的双
窄缝片,则实验中所用单色光的波长为 mm。
|
|
26.(12分)近年来随着科学的发展,用人工的方法在鱼类和两栖类成功实现了两性生殖细胞不经过结合就可以直接发育成新个体,人们把这种现象称为单性生殖。例如,我国著名实验胚胎学家朱洗教授,经过多年的实验,采用玻璃细丝刺激上海蟾蜍卵细胞①的方法,先后获得了25只无父亲的小蟾蜍②,其中一只小蟾蜍在次年3月顺利的产出3000多枚卵细胞③,经受精作用和个体发育,最终获得了新一代蟾蜍④800多只,这是世界上第一批没有外祖父的蟾蜍。
(1)小蟾蜍②是由卵细胞①通过 发育而成。
(2)假如卵细胞③的基因型为AB,那么卵细胞①的基因型为 。
(3)小蟾蜍②的性别是 。
(4)若新一代小蟾蜍④的基因型为aaBB、AaBb、aaBb、AaBB,那么它父母的基因型
分别为 。
27.(14分)探究酸雨危害性的模拟实验。
实验目的:模拟“酸雨”探索对蛙卵孵化的影响。
材料用具:玻璃缸、蒸馏水、以硫酸为材料配制的不同pH<5.6的“酸雨”及同一窝蛙的受精卵。
根据上述材料用具设计实验步骤:
(1)取材:将 分别放入规格相同、盛有等体积的不同pH的“酸雨”
的玻璃缸中,并给玻璃缸编号。
(2)将玻璃缸放在 培养。
(3)观察、记录 ,并分析实验结果。
(4)为使实验更具科学性,还应设置 ,设置方法
|
(1)葡萄糖根本来源于 ;
(2)形成NH3的生理过程d是
(3)在有氧呼吸过程中,图中[H]的来源是
; (4)图中e代表的物质是 。
29.(8分)写出下列反应的化学方程式,并注明反应类型:
(1)2—甲基—2—溴丙烷在NaOH醇溶液中共热:
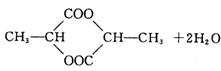
|
(2)两分子乳酸[ ]在浓硫酸存在条件下加热反应生成环状
酯和水:
反应类型为: 。
|
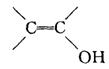
已知 结构不稳定。A有如下性质:
①在溶液中与NaHCO3溶液反应,生成有机物B和无色气体C,C能使澄清的石灰水变浑浊。
②A苯环上的一元取代物只有两种结构。
③在常温下,A可以使Br2的CCl4溶液褪色,且A和Br2只能按1:1进行反应。
④A在Cu作催化剂和加热时与氧气反应生成有机物D,D可以发生银镜反应。
试回答:(1)由①可知A物质中存在的官能团为 ;由③可知A物质中存在的官能团
为 ;由④可知A物质中存在的官能团为 。
(2)试写出A所有可能的结构简式: 。
|
N2+3H2 2NH3
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成amol NH3,这时N2的物质
的量为 mol。
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3 amol,
则开始时放入N2和H2的物质的量分别为 mol和 mol。
(3)若开始时放入![]() N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的
N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的
量分别为![]() mol和3 amol,则
mol和3 amol,则![]() =
,
=
,![]() 。平衡时H2的物质的
。平衡时H2的物质的
量 (选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol B.可能大于、小于或等于6 mol
作出判断的理由是
。
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数
为 。
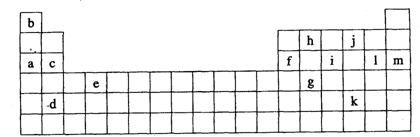
32.(13分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
|
(1)上述所给的元素中,最高价氧化物的水化物酸性最强的是 (填元素符
号),该元素与c元素的单质所形成的化合物属于 晶体。
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子
离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需要的能量(kJ/mol):
|
| 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 508 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 |
| 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需要的能量
要远远大于失去第一个电子所需的能量
②表中X可能以上13种元素中的 (填定字母)元素。用元素符号表示X和j
形成化合物的化学式 。
③Y是周期表中的 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量
最多。
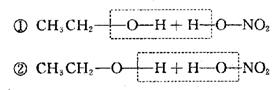
33.(12分)(Ⅰ)已知乙酸和乙醇在浓硫存在的条件下加热可生成乙酸乙酯和水。经研究其
断建的位置如下所示:
 |
|
|
试根据所学的知识,设计一种方法来验证硝酸和乙醇发生酯化反应是按①式的断键形式还是按②式的断键形式进行,用简要文字说明。
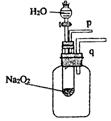
|
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a:有氧气生成 b: 。
Na2O2和H2O反应的化学方程式是 。
(2)某研究性学习小组拟用如图的装置进行实验,以证明上述结论。
用以验证结论a的实验方法是: 。
用以验证结论b的实验方法及现象是: 。
34.(20分)如图所示,两块带有等量异号电荷的平行金属板分别固定在长L=1m的绝缘板
的两端,组成一带电框架,框架右端带负电的金属板上固定一根原长为l0=0.5m的绝缘轻弹簧,框架的总质量M=9kg,由于带电,两金属板间产生了2×103V的高电压,现用一质量为m=1kg、带电量q=+5×10-2c的带电小球(可看成质点,且不影响金属板间的匀强电场)将弹簧压缩△l=0.2m后用线栓住,因而使弹簧具有65J的弹性势能,现使整个装置在光滑水平面上以v0=1m/s的速度向右运动,运动中栓小球的细线突然断裂因而使小球被弹簧弹开。不计一切摩擦,且电势能的变化量等于电场力和相对于电场沿电场方向的位移的乘积。求:
|
速度分别为多大?
(2)通过分析计算回答:在细线断裂以后的运动中,
小球能否与左端金属板发生接触?
唐山市2003—2004学年度高三年级摸底考试
理科综合能力测试评分标准及参考答案
生物部分:(满分80分)
B卷:1.C 2.D 3.C 4.B 5.B 6.D 7.B
26.(共12分,每空3分)
(1)细胞增殖和分化 (2)AB (3)雌性 (4) AaBb 和aB
27.(共14分,最后一空2分,其他每空3分 )(1)等数量(每组约10粒)蛙的受精卵 (2)阳光(温暖,恒温箱)下 (3)蛙卵孵化率 (4)一个空白对照组;将一玻璃缸中盛等体积的蒸馏水,其他步骤一样
28.(共12分,每空3分)(1)植物的光合作用 (2)脱氨基作用 (3)能源物质(葡萄糖、甘油、脂肪酸)和参加反应的水;(缺一点不得分) (4)二氧化碳
化学部分:(满分110分)
选择题:(共48分)
B卷:8. B 9.C 10.A 11.C 12.D 13.B 14.A 15.C
|
|
(1)(3分) (3分)消去反应(2分)
|
|
(2) (3分)取代反应
(酯化反应)(1分)
30.(14分)
|
|
|
| ||||
(2) (各2分)
31.(共13分) (1)1—a/2 (2分) (3)3、9 (各1分) (3)![]() (2分)
(2分) ![]()
(2分) D (1分) 若![]() ,则平衡时H2的物质的量小于6mol,
,则平衡时H2的物质的量小于6mol,
若3a=2,则平衡时H2的物质的量等于6mol
若3a>2,则平衡时H2的物质的量等于6mol(其它合理理由也可)(2分)
(3)a/2(50a%)(2分)
32.(13分)(1)Cl 离子 C(3分,各1分) (2)①Li 原子失去一个电子后,Li+已成为稳定结构,此时再失去一个电子很困难。② a Na2O2 Na2O (4分,每空2分) ③ⅢA (2分)
④m (2分)
33.(14分)
(Ⅰ)96分)用CH3CH![]() OH和硝酸反应,若18O只存在于生成物水中,说明按①式进行断键。若18O只
OH和硝酸反应,若18O只存在于生成物水中,说明按①式进行断键。若18O只
存在于生成物硝酸乙酯中,说明按②式进行断键(其它合理答案也可给分)
(Ⅱ)(8分,每空2分) (1)该反应是放热反应 2Na2O2+2H2O==4NaOH+O2↑
(2)将带火星的木条靠近导管口p,木条复燃 将导管q放入水中,反应过程中导管口有气泡冒出。
物理部分:(满分110分)
|
23.实验(本题共两小题,满分17分)
Ⅰ(1)如图所示(6分)
(2)9.81(9.77—9.85范围内均给分)(4分)
Ⅱ(1)ADCBE(2分)
(2) 1.735 (2分)
(3)576.9 (577同样给分)(3分)
24.题参考解答:
(1)设导体棒的速度为4m/s时,棒中电流为I,
根据法拉第电磁感应定律和欧姆定律得:
![]() ……(1)
……(1)
再利用牛顿第二定律可列出下式:![]() ……(2)
……(2)
代入数值解上述两式可解得:![]() ……(3)
……(3)
(2)设棒达到最大速度时电路中电流为![]() ,根据题意此时应满足:
,根据题意此时应满足:
![]() ……(4)
……(4)
此时电阻R消耗的电功率:![]() ……(5)
……(5)
代入数值解得:P=8W……(6)
本题满分15分其中(1)、(2)、(5)式每式3分,(3)、(4)、(6)每式2分,注:其它解法结果正确同样给分。
25.题参考解答:
(1)设每个人对夯锤施加的力为F,根据牛顿第二定律有:
4F-mg=ma……(1)
施力过程中夯锤上升的高度为![]() ,松手时夯锤获得的速度为
,松手时夯锤获得的速度为![]() ,松手后夯锤能上升的高度为
,松手后夯锤能上升的高度为![]() ,夯锤能上升的最大高度为
,夯锤能上升的最大高度为![]() ,根据运动规律有:
,根据运动规律有:![]() ……(2)
……(2)
![]() ……(3)
……(3) ![]() ……(4)
……(4) ![]() ……(5)
……(5)
代入数值后可解得:![]() ……(6)
……(6)
(2)设夯锤与地面撞击的过程中,地面对夯锤的平均作用力为N,研究夯锤从最高点至落到地面的过程,
应用动能定理可得:![]() ……(7)
……(7)
将![]() 及第(1)问所得结果代入上式可得:N=2.33×104N……(8)
及第(1)问所得结果代入上式可得:N=2.33×104N……(8)
根据牛顿第三定律,N即等于夯锤对地面的平均作用力。
本题满分16分,每式2分。注:其它解法结果正确同样给分。
34.题参考解答:
(1)当弹簧刚好恢复原长时小球与弹簧分离,设此时小球的速度为![]() ,框架的速度为
,框架的速度为![]() ,根据动量守恒
,根据动量守恒
和能量守恒可列出下列方程:![]() ……(1)
……(1)
![]() ……(2)
……(2)
代入数值后解得:![]()
(2)当小球与框架速度相等时,小球相对框架位移最大,根据动量守恒,此时两者共同速度仍为![]() ,设从
,设从
小球被弹开到两者速度再次相等小球对地位移为![]() ,框架对地位移为
,框架对地位移为![]() ,根据动能定理有:
,根据动能定理有:
![]() ……(3)
……(3)
![]() ……(4)
……(4)
代入数值解得:![]()
因![]() ,故小球不会碰到左侧金属板。
,故小球不会碰到左侧金属板。
本题满分20分,(1)(2)(3)(4)每式3分;解得![]() 、
、![]() 正确给3分,
正确给3分,![]() 、
、![]() 正确再给3分,最后结论2分。注:其它解法结果正确同样给分。
正确再给3分,最后结论2分。注:其它解法结果正确同样给分。