点击高考中创新性试题
传统考试中的多数试题是立足于一种沿袭性能力的考查,即要求考生能把过去学过的知识,以再现的方式在试卷中表现出来。试题通过重组、变换、深化的手法可以增加难度。而考生则通过大量习题的操练,来提高解决这类问题的技能,以便在高考中取得较好的成绩。而创新能力的考查试题则由传统的知识立意转变为能力立意,考生不可能简单地用仿效模拟或机械套用去解答问题。它的知识点不但与中学化学知识有密切的联系,更要的是考查了学生的综合应用能力。创新试题,也就所谓的有“噱头”的试题,这些题型的“噱头”在哪儿呢?
一、考查思维深刻性
题目:0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是(2002年上海高考化学22题)
A 30 B 46 C 50 D 66
【错误剖析】本题看似容易,做起来难。作为上海高考最后道选择题,确实也起了压轴的作用。一般考生能想到用极限法估算或者电子得失相等关系来拿下此题,可许多考生却没能如愿,何者?很大程度上是缺乏耐心。有些学生在解题时,一心只想用技巧,当无巧可讨时,又无耐心用常规方法做,最后只得乱选一下答案。实际上,要拿下此题,除了相关知识外,还要有很好的心理素质。所以,此题是一考查知识和心理素质的好题。
【解题思路】由题中最后一句“混合气体的平均相对分子质量可能是”中的“可能”两字,就可猜测出答案很可能是一个范围。如何确定这一范围呢?可采取“先大后小”的方法,因为大范围较容易确定,有时仅根据这一大范围就可找出答案。如本题中平均分子量肯定在NO、N2O4分子量之间(30<M<92),可这一范围B、C、D的答案都在此其中。显然,此范围放得过大,此招不行,只有另辟蹊径了——利用题中的条件将此范围缩小
首先要设平均分子式,再根据氧化还原反应中电子得失相等关系,找关系缩小范围。利用电子得失相等,就要用到化合价,在此可混合气的平均化合价为n,不失一般性,可将混合气的平均分子式设为:![]() 其中,2<n<4 1<x<2
其中,2<n<4 1<x<2
0.03×2=0.05×x(5-n) ![]() 或
或![]()
x、n值的确定:
(1)x 的极限值求n
当x=1时,n=3.8 → M>30.4 ; 当x=2时,n=4.4(n最大为4) →M<92 ,所以用x的极限值求得的n值对解题无用
(2)用n的极限值求x:
当n=2时,x=0.4(x最小为1) ,所以 M>30 ;当n=4时,x=1.2,得M<55.2
其范围为:30<M<55.2
这一范围对解题有效,为此正确的选项为B、C答案
由上可见,该选择题容量很大,一条选择题能否用技巧解决,关键还是看命题者的命题意图,命题者不想让你用巧解来解决,那你就要有耐心,按题给信息,用一般方法去解决。
二、考查思维的严密性
例1 (2001年上海高考题)C8H18,经多步裂化,最后完全转化为C4H8 C3H6 C2H4 C2H6 CH4 五种气体的?昆合物,该混合物的平均相对分子质量可能是 ( )
A.28 B.30 C.38 D.40
[错误分析] 此题的噱头在C8Hl8有多种裂化方式,而有些学生在解题时,只按照课本中正丁烷的分解形式进行。另外, C8Hl8碳原子多了,这部分知识又不课堂中的重点内容,平时轻视了它,这也是出错的另一原因。
[解题思路]气体质量守恒,混合气体的物质的量因裂化方式不同而不同。
![]() (1)C8H18→C4H10+C4H8
(1)C8H18→C4H10+C4H8
C4H10→CH4+C3H6 △n=1
C4H10→C2H6+C2H4
设原有C8Hl0 1mol,则 M=114g/(1+2)mol=38g·mol-1
![]() (2)C8Hl8→C2H4+C6H14
(2)C8Hl8→C2H4+C6H14
C6H14→C2H4+C4H10
C6H14→C2H6+C4H8 △n=1
C4H10→CH4+C3H6
C4H10→C2H4+C2H6
![]()
答案:BC
三、考查实验探究能力
题目:为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)(2003年上海理综26)
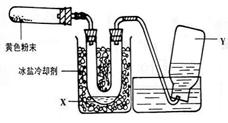 实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)
回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 ;气体Y可能是 。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。
(4)用简单的实验证实(2)中的判断
①对X的判断
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
解答:
(1)NO2气体会损坏橡胶
(2)N2O4(答液态的NO2同样给分);O2
(3)先把导气管移出水面,然后熄灭火焰;防止水槽中的水反吸到U型管中。
(4)①在通风橱中取下U型管放置,观察到U型管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。(其他合理答案同样给分)
同理类推:
1、如图所示,现在一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅。
(1)产生上述现象的原因是______________________________ (请用相关的反应方程式和简要文字说明).
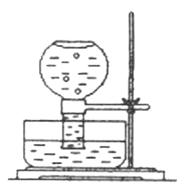
(2)当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,则该同学可采取的合理操作是_________________________________________________________。
(说明:氯水有一定腐蚀性,操作时需戴手套)
解答:
(1)氯气溶于水时发生反应![]() ,
,
光照时![]() ,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗
,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗![]() ,使溶液颜色变浅。
,使溶液颜色变浅。
(2)在水面下用玻璃片盖住瓶口,小心地将烧瓶移出水槽,瓶口向上放于桌上,移开玻璃片,迅速伸入带火星的木条(其它方案若合理均给分,划线部分为3个给分点)。
2、为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
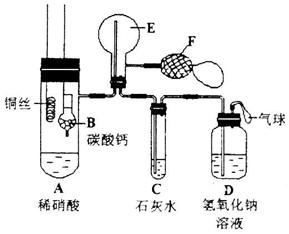
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为_______.
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为_______________________________________________;
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是___________________________。
一段时间后,C中白色沉淀溶解,其原因是______________________;
(3)装置D的作用是________________________________________.
解答:
(1)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气;
(2)![]() ;
;
![]() 比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色
比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色![]() ,当再从F鼓入空气时,E中有更多
,当再从F鼓入空气时,E中有更多![]() 生成,所以红棕色加深;
生成,所以红棕色加深;
二氧化氮与水反应有硝酸生成,硝酸与碳酸钙反应使沉淀溶解;
(3)吸收NO、![]() 、
、![]() 尾气,防止污染大气。
尾气,防止污染大气。
②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2
三、考查对知识的迁移能力
题目:在星际云中发现一种高度对称的有机分子(Z),在紫外辐射或加热下可转化为其他许生命前物质,这些事实支持了生命来自星际的假设。有人认为,Z的形成过程如下:(1)星际分子CH2=NH聚合生成X;(2)X与甲醛加成得到Y(分子式为C6H15O3N3)Y与氨(物质的量之比为1:1脱水缩合得到Z。试写出X,Y和Z的结构简式。
命题意图:本题为99年高中化学竞赛题,它以课本中“聚合”、“加成”、“缩聚”反应类型为载体,考查学生对所学知识的综合应用能力。本题充分体现“起源于课本而跃出课本”的高考新特点。
解题思路:
1、审题,进行信息初加工,使复杂问题明朗化
当我们面对一个复杂的问题时,将题目中的信息进行高度浓缩,提取其精华,使问题的条件、求解更加明显,借以触发解题的灵感,畅通解题的思路,为迅速突破难点做好准备。如本题的信息可浓缩如下:
![]() (高度对称)
(高度对称)
![]() 2、整体思维,各个击破,确定最佳解题途径
2、整体思维,各个击破,确定最佳解题途径
由初加工信息可见,直接从正向推导,比较困难,因为分子的空间结构难确定。如果从逆向来思考,推导就显得容易。空间结构的推断: Z是高度对称性的分子,因此,Y、X分子结构也具有高度对称性;分子组成的推导:由Y的分子式和甲醛的分子式,再结合反应基本类型,不难推导出X的分子式和结构式,由此可见,本题逆向推导较容易。
3、调用所学知识,进行联想类比,将陌生问题熟悉化
遇到情景陌生的新问题,当你感到一筹莫展时,不妨选择一个与之类似熟悉的问题相比较,设法寻找两者之间的联系和相似之处,用解决熟悉问题的方法和结论去探求新问题。
Y是由X和甲醛加成所得的产物,由于Y的分子式为C6H15O3N3,分子中有3个氧原子,所以X和3个甲醛分子发生了加成,再利用加成反应的基本图式"A+B=C"可得X的分子式,其计算表达式为:X=Y-3CH2O= C6H15O3N3-3CH2O= C3H9N3, 即X为-[CH2—NH]3-,此式和聚乙烯有相似之处,只不过是聚合度为3而已。由于X分子空间结构也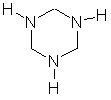
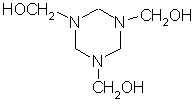
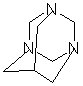
有高度的对称性,所以其分子空间结构应是一个对称环状三聚体(如图1所示)。
|
|
|
根据缩合反应基本图式"A+B=C+D"及其反应特点是从反应物"母体"中脱除“小分子”,从Y的结构里发现它含有3个羟基,而氨分子又具有3个氢原子,两者按1:1缩合脱去3个分子水,故Z具有空间结构(如图3所示)。
启示:在平时的学习中,对课本中的基本概念不可放松,要吃透内涵及外延,这是解能力题的基础,不重视基础,好高骛远是学习中的大忌!
四、考查对知识的类推能力
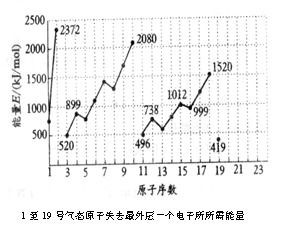 题目:不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
题目:不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1) 同主族内不同元素的E值变化的特点是____。各主族中E值勤的这种变化特点体现了元素性质的________ 变化规律。
(2) 同周期同,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系中正确的是_______(填写编号,多选扣分)。
①E(砷)> E(硒);②E(砷)<E(硒);③E(溴)>E(硒);④E(溴)<E(硒)
(3) 估计mol气态Ca原子失去最外层一个电子所需能量E值的范围:______<E<_______。
(4) 10号元素E值较大的原因是_______________。(本题为上海市2000化学高考试题)
解析:上图提供了不同元素的气态原子失去最外层一个电子所需要的能量E值的变化曲线,要求考生通过对图表的阅读,根据元素在周期表中的位置,找出随着原子序数递增,气态原子失去最外层一个电子所需要的能量E值的变化规律,并回答问题。
(1) 同主族不同元素的E值变化特点:以3,11,19号元素为例不难发现随着原子序数的增大,E值变小。同周期内随着原子序数的增加,E值逐渐增加。其中有些元素出现反常现象,但是同主族的元素,随着原子序数的增大,E值变小,且出现反常的元素在同一主族内。因此各主族E值的变化特点体现了元素性质的周期性变化规律。
(2) 根据以上分析,判断第四周期元素砷、硒、溴E值的大小。第二周期的氮、氧和第三周期的磷、硫元素,E值均出现了反常现象;而第二周期的氧、氟,第三周期的硫、氯E值随着原子序数的增大而增大。因为,周期表中各元素E值的变化呈现出周期性,因此,E(砷)>E(硒)>E( 溴)。
(3)要估计1mol气态Ca原子失去最外层一个电子需E值的范围,从第二主族的铍、镁元素的变化着手,E(铍)>E(镁)。因此,E(镁)>E(钙),得出:E(镁)>E(钙)>E(钾)。
说明10号元素E值较大的原因是:10号是氖,该元素原子的最外层电子排布已达8电子稳定结构,不易失去电子故E值大。
该题的内容教材中没有直接叙述,要求考生分析图中曲线特点,结合所学元素周期律知识,进行纵向、横向比较,从分析中做出预测、推断,实现文字、图表等信息的转换和加工处理。
高考命题可粗略分为两类,即沿袭与创新,从功能上看,这两类试题各有其作用,不可偏废某一方,沿袭是一种对知识的继承,是强化基础的必由之路,创新是知识撞击的火花,是一个由量变到质变的过程。所以,我们既要强调基础训练,更要注重对学生能力的培养。在习题选编中体现“起源于课本而跃出课本”的命题原则。让学生跳一跳方可摘得到,最大限度地促进学生由知识向能力转化。