1999化学竞赛训练题(5)(180分钟)
姓名 成绩 名次
一、(25分)镀铬通常是以电解铬酸的方法进行的。阴极是欲镀铬的物体,阳极是一种合金,它在电镀时是惰性的,既不发生化学反应也不发生点化反应。设某镀铬的电镀(槽)液为含铬酐0.230g.L-1,体积100.0L的水溶液。电解时使用1500A的电流通电10.0小时,电解后阴极的质量增加了0.679Kg。在电解的过程中两极都同时有气体放出,两极放出气体体积比为V阴极:V阳极=1.603。请回答:
铬酐的化学式是CrO3。它与水反应生成铬酸。由于铬酸在水里存在型体比较复杂,为简便起见,可以用铬酐来表示电镀液中的铬的含量,并用铬酐的形式来说明电镀过程中发生的电化学反应。
1、电解过程消耗的总电量是多少?
2、电流效率是指发生某电化学反应耗用的电量占总电量的百分比。经测定,上述电镀过程中沉积的金属铬的质量为0.679Kg。求电解过程中发生铬的沉积的电流效率。
3、在镀铬过程中阴极和阳极放出的气体分别是什么?试用化学方程式来表示铬的沉积和气体的放出。
4、若按化学反应来计算阴极和阳极放出的气体的体积比,得到的计算结果与实验测定的气体的体积比是否相同?
5、假设在镀铬过程中只发生上述化学反应,并忽略非化学过程引起的电能消耗,试根据铬的沉积的电流效率和实验测定阴极和阳极放出的气体的体积比,计算出气体的电化学反应的电流效率各为多大。
6、你认为在镀铬过程中还可能发生什么化学过程或电化学过程?
二、(20分)金属钠和金属铅的2 :5(摩尔比)的合金可以部分地溶解于液态氨,得到深绿色的溶液A,残留的固体是铅,溶解的成分和残留的成分的质量比为9.44 :1,溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+和NH2-)外,只存在一种阳离子和一种阴离子(不考虑氨合的成分),而且它们的个数比是4 :1;阳离子只带一个电荷。通过电解,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨里电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到等当点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。回答下列问题:
1、写出溶液A中的电解质的化学式。
2、写出上述滴定反应的配平的离子方程式。
3、已知用于滴定的PbI2液氨溶液的浓度为0.009854 mol.L-1,达到滴定终点时消耗
PbI2液氨溶液21.03 mL,问共析出金属铅多少克?
三、(18分)电解水 2H2O = 2H2+O2 在阳极得氧气,阴极得氢气。从理论上讲,阴阳极生成气体体积比为2 :1。现在将某条件下电解(1)NaOH 溶液、(2)H2SO4溶液的实验结果列于下表:
| 时间(mit) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| (1)阴极生成气体体积(mL) | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| 阳极生成气体体积(mL) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| (2)阴极生成气体体积(mL) | 6 | 12 | 20 | 27 | 34 | 42 | 50 | 58 | 66 | 74 |
| 阳极生成气体体积(mL) | 1 | 2 | 4 | 5 | 10 | 13 | 16 | 19 | 22 | 25 |
相对于阴阳极生成气体体积比为2 :1的理论值,(1)、(2)的实验偏差既相似又不同,请你具体说明并解释其原因。
四、(20分)某污水处理厂用生物方法处理废水。在废水中所含糖类(CH2O)n杂质有45%被完全氧化,另有10%经发酵过程进行无氧分解生成两种化合物。其余部分仍留在沉积物中。该厂每天共产生16m3的气体(25oC,100kPa)。
(1)每天有多少kg糖类留在沉积物中?
(2)通过燃烧生成的甲烷,每天可以产生多少热能?(燃烧热为—882kJ.mol-1)
(3)如果废水中糖类杂质的浓度为250mg.dm-3,该污水厂每天处理了多少m3污水?
五、(15分)(甲、乙两题,任选一题回答)
(甲题)钼有一种含氧酸根[MoXOY]Z -,式中X、Y、Z都是正整数;Mo是+6价,O呈-2价。可按下面的步骤来理解该含氧酸根的结构:
(A)所有Mo原子的配位数都是6,形成[MoO6]n -呈正八面体,称为“小八面体”(图A)
(B)6个“小八面体”共棱连接可构成一个“超八面体”(图B)
(C) “孪超八面体”可由两个“超八面体”共用2个“小八面体”形成(图C)
回答:(1)小八面体的化学式[MoO6]n –的n = 。(2)超八面体的化学式是 。(3)孪超八面体的化学式是 。
(乙题) 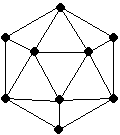 晶体硼的基本结构单元都是由硼原子组成的正二十面 体的原子晶体,其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察右边图形,回答:
晶体硼的基本结构单元都是由硼原子组成的正二十面 体的原子晶体,其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察右边图形,回答:
(1) 这个基本结构单元由 个硼原子组成,
键角是 ,共含有 个B-B键。
(2) 如果这个正二十面体是独立的而不是无限的,在每个B-B键长的三分之一处切掉所有的硼原子,形成的是 面体。如果在此新形成的多面体的每个顶点上换上碳原子,就是一种新的微粒,其化学式为 。
六、(16分)Fmaks法治理硫化氢的方法和步骤为:(1)用2% ~ 3%的苏打溶液作吸收剂生成2种酸式盐。(2)再加入一种RNO(R表示芳香烃基)与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH。(3)第二步生成的碱在溶液中与另一种酸式盐反应生成正盐。(4)RNHOH与空气中的氧气发生反应又得到RNO。写出上述四步反应的化学方程式。
七、(18分)A、B为两种单质,常温下均为固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份完全相同的质量均为1.52g的A、B的混合物(粉末)进行如下实验。(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896L气体(标准状况下),并且还余下0.56g残渣;(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896L气体(标准状况下) ,还余下0.96g残渣;(c)将第三份试样隔绝空气加强热后,生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生xL气体。
(1)单质A是 。
(2)混合物中B的质量分数是 。
(3)写出实验(c)中有关反应的化学方程式并计算x的值(标准状况下)。