万寿镇初二OO五级化学模拟考试(一)
学校 班级 考号 姓名
可能用到的相对原子质量:H 1, O 16, S 32, Cl 35.5, K 39, Mn 55, Mg 24, Zn 65, Ba 137, Fe 56, Na 23 Cu 64 Ca 40 Ag 108 Al 27
一、选择题(每小题只有一个选项符合题意,本题包括20小题,共40分。)
1. 下列过程中,不涉及化学变化的是 ( )
A.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
B.在蒸馒头时,加入适量的纯碱使馒头疏松多孔
C.烧菜用过的铁锅,经常出现红棕色斑迹 D.家庭自制冰块
2. 下列各组中属于有机化合物的一组是 ( )
A. 石墨、活性炭 B. 甲烷、碳酸钙 C. 石墨、二氧化碳 D. 甲烷、酒精
3. 下列各物质的分类中,有错误的是 ( )
A. 氧化物:干冰、水 B. 酸:氢氯酸、硝酸 C. 碱:纯碱、烧碱 D. 盐:胆矾、石灰石
4. 下列说法正确的是 ( )
A. 均一、稳定的液体都是溶液
B. 131.6克硝酸钾溶液蒸干得31.6克硝酸钾,硝酸钾溶解度为31.6克
C. 浓溶液一定是饱和溶液 D. 温度升高,固定溶解度不一定都增大
5. 硫在氧气里燃烧时产生 ( )
A. 蓝紫色火焰 B. 白烟 C. 耀眼强光 D. 淡蓝色火焰
6. 含硫的煤不完全燃烧时,排放出污染环境的气体是 ( )
A. 只有CO B. 只有SO2 C. CO和CO2 D.SO2和CO
7. 已知:甲为固体,乙、丙、丁为气体,在一定条件下,它们之间可发生下列反应:![]() ,则甲可能是
( )
,则甲可能是
( )
A. Fe B. CuO C. CaCO3 D. C
8. 下列物质中,既有可燃性又有还原性的气体单质是 ( )
A. 氢气 B. 活性炭 C. 一氧化碳 D. 二氧化碳
9. 某溶液中含有Al3+、Mg2+、SO42--、NO3—四种离子,请根据选项判断,该溶液中Al3+、Mg2+、SO42--、NO3—的个数最简整数比依次可能是 ( )
A.1:3:5:3 B.1:3:2:2 C.5:2:7:5 D.1:2:3:4
10. 下列各组物质能发生反应,并且有氯化铜生成的是 ( )
A. 铜和盐酸 B. 氧化铜和盐酸 C. 铜和氯化银 D. 氯化钠溶液和氧化铜
11. 区别![]() 三种无色溶液应选用
( )
三种无色溶液应选用
( )
A. ![]() 溶液 B.
溶液 B.
![]() 溶液 C.
稀
溶液 C.
稀![]() D.
稀
D.
稀![]()
12. 下列各组物质的溶液混合,如果其中的酸过量,仍有沉淀生成的是 ( )
A. ![]() B.
B.
![]()
C. ![]() D.
D. ![]()
13. 下列实验操作,正确的是 ( )
A. 把水倒入盛浓硫酸的量筒里 B. 把氢氧化钠放在天平托盘上的滤纸上称量
C. 氢气还原氧化铜完毕,先停止通氢气,再熄灭酒精灯
D. 制取氧气结束时,先将导管移出水面,再熄灭酒精灯
14. 某工厂的技术人员在治理该厂排放的一种澄清废液时,先加入氯化钡溶液,产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并产生一种使澄清石灰水变浑浊的气体,下列说法正确的是( )
A. 废液中一定含有![]() B. 废液中一定含有
B. 废液中一定含有![]() C. 废液中一定含有
C. 废液中一定含有![]() D. 废液中有
D. 废液中有![]()
15. 托盘天平两端各放置盛有等质量分数的足量的稀硫酸的烧杯,调节天平至平衡,向左边烧杯中加入8g氧化铜,若使天平仍保持平衡,需向右边烧杯中加入的是 ( )
A. 8.5g锌 B. 8.3g铁 C. 8.6g铝 D. 8g银
16.我国政府在新的发展形势下,提出了“科学发展观”。下列行为中不符合这一主题的是( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃 D.节约能源,提高能源利用率
17、某温度下,在100ml饱和石灰水中加入少量生石灰,充分反应后恢复到原来的温度。下列判断正确的是 ( )
A.溶液中溶质的质量分数增大 B.溶液中Ca(OH)2的质量不变
C.Ca(OH)2的溶解度减小 D.溶液中Ca2+数目减少
18、在蔬菜生长过程中,常喷洒农药防治病虫害,据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药的毒性降低。因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间。浸泡蔬菜时可以加入适量 ( )
A.纯碱 B.白酒 C.白糖 D.食醋
19、
|
A.分别加热相同质量的氯酸钾和高锰酸钾制氧气 B.相同质量的镁、锌跟足量的稀硫酸反应制取氢气
C.在质量一定、溶质的质量分数一定的稀硫酸中,逐渐加入氢氧化钡固体
D.某温度下,在饱和的KNO3溶液中,逐渐加入KNO3晶体
20. 粗盐中常含有CaCl2、MgSO4等杂质,可加入过量的NaOH、BaCl2、Na2CO3溶液和适量稀盐酸,除掉杂质制得精盐,则所加这四种物质先后顺序正确的是 ( )
A. Na2CO3、、BaCl2、HCl、NaOH B. NaOH、BaCl2、Na2CO3、HCl
C. Na2CO3、NaOH、BaCl2、 HCl D. NaOH、Na2CO3、HCl、BaCl2
![]() 二、填空题(每空1分,
本大题共35分)
二、填空题(每空1分,
本大题共35分)
21、某微粒的结构示意图为 ,该元素的原子:核内有______个质子、最外层上有______个电子,该元素属(金属或非金属)________元素。
22、按要求用正确的化学符号表示:
⑴空气中含量最多的气体 ⑵.m个乙醇分子
⑶.两个亚铁离子 ⑷.硫化钾中硫元素的化合价
23. 配平下列反应方程式:(每个小题1分)
(1)![]() (2)
(2)![]()
24.从H、O、Cl、K、Cu五种元素中选择适当的元素,组成有关物质,按下列要求写出有关的反应方程式。(1)两种单质化合生成水________________________________________________
(2)一种盐可分解成使带火星木条复燃的气体_______________________________________
(3)一种单质与一种氧化物发生置换反应生成红色物质_______________________________
(4)一种盐与一种碱反应生成蓝色沉淀_____________________________________________
25. 将![]() 和
和![]() 混合气体依次通过
混合气体依次通过![]() 溶液、氢氧化钠溶液、灼热铁丝、灼热氧化铜、浓硫酸最后剩下的气体是___________________。
溶液、氢氧化钠溶液、灼热铁丝、灼热氧化铜、浓硫酸最后剩下的气体是___________________。
26. 四种白色固体(1)氯化钠(2)氯化钡(3)无水硫酸铜(4)硫酸钠,除用水以外,不用其他方式就可把它们区分开。其区分的先后顺序是____________________(写序号)。
27. 某工厂的废液中混有少量锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸混合形成污水,产生公害。若向污水中撒入铁粉,且反应后铁粉有剩余,此时污水中一定含有的金属离子是___________。
28.把80克溶质质量分数为10%的硫酸溶液稀释成溶质质量分数为4%的硫酸溶液需加入_______克水。
29.天然气的主要.成分是甲烷(CH4),它是一种“清洁能源”.甲烷在空气中完全燃烧生成二氧化碳和水,写出该反应的化学方程式:_______________________________________.城市煤气中通常含有CO气体,写出CO燃烧的化学方程式:_________________________________________。煤气与天然气相比,从安全角度看,煤气的主要缺点是____________________.从环境保护的角度考虑,煤气、天然气和氢气中,首选的燃料是___________________.
30.①纯净的氮气是没有颜色的、没有气味的气体.②在放电的情况下,氮气能跟氧气直接化合生成一氧化氮气体.③一氧化氮不易溶于水,在常温易跟空气中的氧气化合,生成红棕色的二氧化氮气体.④二氧化氮有毒,易溶于水.二氧化氮溶于水后生成硝酸和一氧化氮.⑤生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶性的硝酸盐.(1)短文中描述氮气的化学性质的句子是_________;(填番号)2)实验室制取一氧化氮气体,宜用_____________法收集;(3)写出二氧化氮与水作用的化学方程式__________________________________________;
(4)“雷雨发庄稼”.意思是,雷雨过后,土壤中的养分增多了,有利于植物的生长.其原因是__________________________________________________________________________________.
31.有含氮物质:①N2 ②N2H4 ③HNO3 ④N3 ⑤N5 ⑥N6O等.
(1)其中属于单质的有(填序号)________,属于化合物的有(填序号)________.
 (2)N5的分子极不稳定,需保存在-80℃的干冰中.通常状况下,它采取爆炸式的反应生成氮气.该反应的化学方程式为________________________________.
(2)N5的分子极不稳定,需保存在-80℃的干冰中.通常状况下,它采取爆炸式的反应生成氮气.该反应的化学方程式为________________________________.
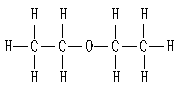
32. 乙醚是人类很早就使用的有机麻醉剂,分子结构如图所示,
其中短线表示原子间的连接(例如水分子的结构可表示为
H—O—H)。乙醚的化学式为________________;乙醚在纯氧
中燃烧的化学方程式为:________________________________________________________。
33. 除去氯化钠中混有的少量碳酸钠,应选用的一种试剂是_________________.
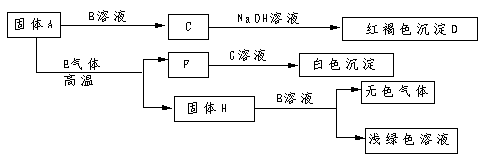 34.下列图示表示各物质间的转化关系:
34.下列图示表示各物质间的转化关系:
根据推断,把下列字母所代表的物质的化学式填在相应的空格内:
A._________ D._________ G._____________ H.____________
三、实验题(共15分)
35. (3分)实验室制取![]() ,只需固体药品制取的是_________,既能用稀硫酸又能用稀盐酸制取的是______________,只能用向上排空气法收集的是______________。
,只需固体药品制取的是_________,既能用稀硫酸又能用稀盐酸制取的是______________,只能用向上排空气法收集的是______________。
36.(4分)粗盐提纯的操作步骤是_____________、_____________、____________、洗涤。硝酸钾中混有少量食盐可用______________________方法除去。
37.(2分)在(1)药勺(2)漏斗(3)托盘天平(4)烧杯(5)量筒(6)酒精灯(7)玻璃棒(8)铁架台8种仪器中,写出用固体食盐配制50克5%食盐溶液,必备的五种仪器是(写序号)_____________________。
 38.(2分)某厂实验室有甲乙两个药品橱,其中甲橱是空橱,乙橱存放有铜和铁,现在碳酸钙、浓硫酸、烧碱、浓盐酸、氧化钙,应该分别把它们放在哪个橱中?甲橱:
,乙橱:铜、铁
。
38.(2分)某厂实验室有甲乙两个药品橱,其中甲橱是空橱,乙橱存放有铜和铁,现在碳酸钙、浓硫酸、烧碱、浓盐酸、氧化钙,应该分别把它们放在哪个橱中?甲橱:
,乙橱:铜、铁
。
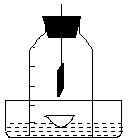
39.(5分)某同学用镁条代替红磷做空气中氧气含量测定实验,所用装
置如图:用蒸发皿来承接反应生成物。 ⑴.试分析该同学的实验设计的
化学原理(用化学方程式表示)
⑵.实验时,将点燃的镁条迅速插入钟罩内,塞紧瓶塞,到冷却至室温后,发现钟罩内液面上升至2/5以上,该同学愕然了。你能分析出其中可能的
原因吗? ___
⑶.取出蒸发皿,向其中固体中滴入水,迅速反应,产生刺激性气味的气体,用湿润的红色石蕊试纸试验,试纸变蓝色;分析此时蒸发皿中的物质,发现有一不溶碱。通过查阅资料得知:蒸发皿中的固体除氧化镁之外还有氮化镁(化学式为Mg3N2)请写出氮化镁与水反应的化学方程式:
⑷.如果改用木炭代替红磷做此实验,钟罩内水面上升最终将 1/5体积(填“大于”、“小于”或“等于”),如何改进此实验,使液面上升约为1/5体积 _______ ________
四. 计算题(40题3分,41题7分,共10分)(最后结果精确到0.1)
40.某同学用足量的CO将16克氧化铜完全还原成了铜,试求反应后生成的铜的质量是多少?
41.在氯化钡和氯化钠组成的混合物中,取其28克置于50克水中充分溶解后,加入71克某溶质质量分数的硫酸钠恰好完全反应,生成沉淀23.3克。计算:(1)原混合物中氯化钠的质量。(2)滤去沉淀,某温度下在所得滤液中加入19.6克氯化钠固体,刚好为饱和溶液,计算该温度下溶质的溶解度。
万寿镇初二OO五级化学模拟考试(一)
参 考 答 案
一:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | D | C | D | A | D | D | A | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | C | D | A | D | B | D | A | C | B |
二:21。13;3;金属;
22.N2;mC2H5OH;2Fe2+;K2S
23.3;4;1;4;4;11;2;8
24.2H2+O2点燃2H2O;2KClO3△2KCl+3O2↑;H2+CuO △ Cu+H2O;CuCl2+2KOH==Cu(OH)2↓+2KCl;
25.CO2和N2;
26.③②④①;
27.Zn2+和Fe2+;
28.120;
29.CH4+2O2点燃CO2+2H2O;2CO+O2点燃2CO2;有毒;氢气;
30.②;排水;3NO2+H2O==2HNO3+NO;因在放电时,氮气与氧气化合为NO,NO再氧化成NO2,NO2再与水反应生成硝酸,硝酸与土壤中矿物质作用生成硝酸盐,这就为庄稼提供了氮肥,所以有利于植物的生长。
31.①④⑤;②⑥;2N5爆炸5N2;
32.C2H5OC2H5(或C4H10O); C2H5OC2H5+6O2 点燃 4CO2+5H2O
33.稀盐酸;
34.Fe2O3;Fe(OH)3;Ca(OH)2;Fe;
三.35.O2;H2;CO2;
36.溶解;过滤;蒸发;冷却热饱和溶液;
37.③④⑤⑦①;
38.浓硫酸、浓盐酸;氧化钙、烧碱、碳酸钙;
39.2Mg+O2 点燃 2Mg;可能是Mg和N2发生反应生成了固体;把水改成溶液NaOH或碱溶液。
四.40.12.8g;
41. 33. 设:需![]() 的质量为x,需
的质量为x,需![]() 的质量为y,生成NaCl的质量为z,
的质量为y,生成NaCl的质量为z,
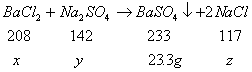
分别解得![]()
(1)原混合物中
![]() 的质量
的质量![]()
(2)饱和溶液中
![]() 的质量
的质量![]()
![]() 的质量
的质量![]()
溶解度![]()
答:略