2006年浙江省高中学生化学竞赛试题(A组)
考生须知:
1.全卷分试题和答题卷两部分。试题共有六大题,26小题。满分150分。考试时间120分钟。
2.本卷答案必须做在答题卷相应位置上,做在试题卷上无效,考后只交答题卷,必须在答题卷上写明县(市)、学校、姓名、准考证号,字迹清楚。
| H 1.008 | 相对原子质量 | He 4.003 | |||||||||||||||
| Li 6.941 | Be 9.012 | B 10.81 | C 12.01 | N 14.01 | O 16.00 | F 19.00 | Ne 20.18 | ||||||||||
| Na 22.99 | Mg 24.31 | Al 26.98 | Si 28.09 | P 30.97 | S 32.07 | Cl 35.45 | Ar 39.95 | ||||||||||
| K 39.10 | Ca 40.08 | Sc 44.96 | Ti 47.88 | V 50.94 | Cr 52.00 | Mn 54.94 | Fe 55.85 | Co 58.93 | Ni 58.69 | Cu 63.55 | Zn 63.39 | Ga 69.72 | Ge 72.61 | As 74.92 | Se 78.96 | Br 79.90 | Kr 83.80 |
| Rb 85.47 | Sr 87.62 | Y 88.91 | Zr 91.22 | Nb 92.91 | Mo 95.94 | Tc [98] | Ru 101.1 | Rh 102.9 | Pd 106.4 | Ag 107.9 | Cd 112.4 | In 114.8 | Sn 118.7 | Sb 121.8 | Te 127.6 | I 126.9 | Xe 131.3 |
| Cs 132.9 | Ba 137.3 | La-Lu | Hf 178.5 | Ta 180.9 | W 183.8 | Re 186.2 | Os 190.2 | Ir 192.2 | Pt 195.1 | Au 197.0 | Hg 200.6 | Tl 204.4 | Pb 207.2 | Bi 209.0 | Po [210] | At [210] | Rn [222] |
| Fr [223] | Ra [226] | Ac-La | |||||||||||||||
一.选择题(本题包括10小题,每小题4分,共40分,每小题只有1个正确答案)
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是
A.“钴酞菁”的小分子没有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局部的化学反应来改变和控制分子的物理性质
2.用即热饭盒盛装食物,可以得到热烘烘的饭菜。原因是即热饭盒的底部装入了混有镁、铁粉末的高密度聚乙烯,进行简单的操作后,水和镁就会发生剧烈的化学反应,放出热量便可使食物变热。其中铁可能是
A.一种反应物 B.催化剂 C.起导热作用 D.增大镁与水分子接触机会
3.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合液中,生成沉淀与通入CO2的量的关系可表示为
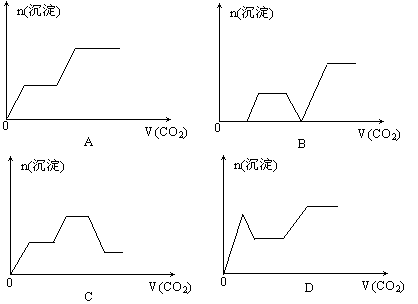
4.“拟晶”是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是二十世纪发现的几百种似晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A. Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B. Al65Cu23Fe12中三种金属的化合价均可视作零
C. Al65Cu23Fe12不可用作长期浸泡在海水的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
5.主链为4个碳原子的某烷烃有2种同分异构体。则与这种烷烃具有相同的碳原子数、主链上也为4个碳原子的单烯烃,共有异构体
A.3种 B.4种 C.5种 D.2种
6.酸碱批示剂(HIn)在水溶液中存在以下电离平衡:HIn(红色)![]() H++In-(黄色)。请判断浓度为2×10-2
mol·L-1的下列溶液:①盐酸 ②澄清石灰水 ③氢化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液 ⑥磷酸二氢铵溶液 其中能使该指示剂显红色的是
H++In-(黄色)。请判断浓度为2×10-2
mol·L-1的下列溶液:①盐酸 ②澄清石灰水 ③氢化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液 ⑥磷酸二氢铵溶液 其中能使该指示剂显红色的是
A.①④⑥ B.①②③④⑤⑥ C.①③④⑤ D.其他组合
7.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(l)===NH4I+NH2At
下列关于AtI性质的叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B. ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D. AtI与液氨反应,是自身氧化还原反应
8.11.87g金属锡跟100 mL2mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)=8mol·L-1,溶液体积仍为100mL。放出的气体在常压下加热到100℃时体积为12.24L。由些推断氧化产物可能是
A.Sn(NO3)2 B. Sn(NO3)4 C.SnO2·4H2O D. Sn(NO3)2和Sn(NO3)4
9.用键能可以估算反应热,当以键能来估算反应时,下列方程式符合要求的是
A.CH3COOH(l)+CH3CH2OH(l) == CH3COOCH2CH3(l)+H2O(l)
B.C(石墨)+O2(g) == CO2(g)
C.CaCO3(s)+2HCl(aq) == CaCl2+CO2(g)+H2O(l)
D.CO(g)+![]() O2(g) == CO2(g)
O2(g) == CO2(g)
10.某油脂样品跟氢氧化钠共热后共生成了5种有机物,原样品最多可能含有的三羧酸甘油酯种数为
A.5种 B.18种 C.75种 D.40种
二.选择题(本题包括8小题,每小题4分,共32分。每小题有1~2个正确答案。若有两个正确选项,只选一个且正确的给2分,多选、错选都给0分)
11.下列各组物质混合后,既产生无色气体,又产生白色沉淀的是
①Ba(NO3)2溶液跟NaHSO3溶液 ②Ba(OH)2溶液跟(NH4)2SO4溶液共热 ③电石跟苏打水 ④三氧化铁溶液跟碳酸钠溶液
A.①②③ B.②③ C.①②③④ D.②③④
12.下列物质不可能通过化合反应制取的是
A.Fe(OH)3 B.Al(OH)3 C.HgS D.CuS
13.下列化学反应不能说明碳与硅的非金属性强弱的事实是
A.CO2+H2O+Na2SiO3===Na2CO3+H2SiO3
B.CaCO3+SiO2![]() CaSiO3+CO2
CaSiO3+CO2
C.SiO2+2C![]() Si+2CO
Si+2CO
D.Si+C![]() SiC
SiC
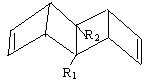 14.始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列说法中正确的是
14.始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列说法中正确的是
A.始祖鸟烯与乙烯互为同系物
B.若R1=R2= -CH3,则其化学式为C12H16
C.若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾溶液褪色也能使溴水褪色,其原理是一样的
15.自然界早存在一种尖晶石,主要成分的化学式可表示为MgAl2O4,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4 g,恰好完全溶解在一定浓度100 mL 盐酸溶液,盐酸浓度可能是
A.2.2 mol·L-1 B.2.8mol·L-1 C.4.3 mol·L-1 D.4.9mol·L-1
16.短周期的X、Y两种元素,X原子半径小于Y原子半径,两种元素可形成X是正价的AB2型化合物,下列关于两元素的叙述正确的是
A.X、Y可能属于同一周期 B.X是Y的前一周期元素
C.只能是金属元素 D.X可能是第二周期IIA族或IVA族元素
17.某密闭容器中进行如下反应:X(g)+2Y(g)![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
A.1<![]() <3
B.
<3
B.![]() <
<![]() <
<![]() C.3<
C.3<![]() <4 D.
<4 D.![]() <
<![]() <
<![]()
18.NH3和O2混合气100mL,通过红热的铂网,充分反应后的混合气体再通过足量水最终收集到10 mL残留气体,则源混合气中O2体积不可能是(气体体积在相同条件下测定)
A.12.5 mL B.21.5mL C.64.2mL D.70.0mL
三、(本题共有2小题,共20分)
19.(10分)本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受一个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶或抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2和一种过氧化物。NO2在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在λ=530nm处有显著吸收,且其吸收值与c(NO2)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2)=2.500×10-3mol·L-1。
(1)请根据测定原理写出有关反应的离子方程式: ;
(2)计算该样品此时c(O2-)= ;
(3)如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(KMnO4或K2Cr2O7,任选一种即可)
①请写出其测定原理的反应方程式:
②测定所用的主要玻璃仪器为 ,通过观察 的现象可确定测定反应是否进行完全。
20.(10分)以下素材是某课外实验小组的实验记录,请根据实验记录回答有关问题。
实验内容:铜与硝酸反应有关问题的探讨
实验器材:电线细铜丝,1mol·L-1HNO3,14mol·L-1HNO3,碱石灰,玻璃丝,Cu(NO3)2晶体,酒精灯,试管,夹持器械,火柴。实验装置和记录如下:
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1 g细铜丝放入盛有10mL1mol·L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1 g细铜丝放入盛有10mL14mol·L-1HNO3的试管中加热 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol·L-1HNO3 | 溶液仍呈深蓝色 |
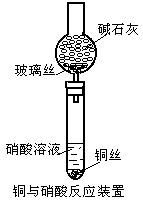 请回答:
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是 (写化学式)
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是
。
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因
_______________________,设计两种不同的简单实验方法证明你的解释:
方案①
方案② 。
四、(本题共2小题,共18分)
21.(8分)已知固体甲、E、I、F均为常见单质,其中E在常温下为气态。W是由两种短周期元素组成。乙通常是一种红棕色粉末。C为白色胶状沉淀。W、G、H、I三种物质中都含有同一种短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比为1 :2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
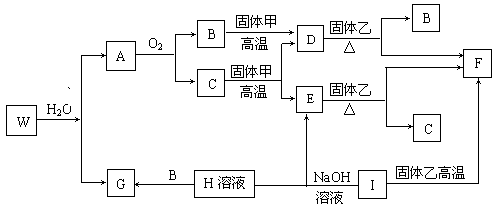
(1)B的电子式为 ,F原子的结构简图为 。
(2)在上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B等反应中有多个反应属置换反应,根据要求写出反应式。
非金属元素之间的置换反应 ;
金属单质置换非金属单质的置换反应 。
(3)写出W和水反应的化学方程式 。
22.(10)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命题的构架元素,E是同周期中半径最小的元素,也是浓缩分离(U)的原料,游离态的E是经过几代人以生命为代价,最终由莫瓦桑制得而获得1906年锘贝尔化学奖,G的最高价含氧酸的产量是衡理一个国家化工实力的标志。它们的原子序数存在如下关系:①a+b=c,②![]() ,③
,③![]() ,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G)。
,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G)。
(1)A2是最理想的绿色能源,一般情况下固化得到的是分子晶体。20世纪末,美国卡内基实验室曾获得了它的金属晶体,进一步证明了英国物理学家贝纳尔在1925年的预言:“只要创造条件,任何非金属材料都能变成金属”的正确性。你认为由分子晶体A变成金属晶体A的最必要条件是 。
(2)铀是重要的战略物资,它有三种同位素234 92U、235 92U、238 92U,其中235 92U是核材料。但是235 92U与238 92U是形影相随的。分离方法是利用U与E形成UE6气体(E不存在同位素),再进行一定的操作。请简述235 92U与238 92U的分离原理是 。
(3)碘的非金属性比G强,G2-的还原性比I-强,由此 (填“能”或“不能”)类推出GBC-、I-的还原性强弱,你的理由是 。
(4)配平反应方程式: (GC)4+ ACl===G4C3Cl+ Cl2+CA4Cl(注意:Cl是氯)
 (5)由(GC)4·G4C3+,其空间构型发生了很大变化。(GC)4是由半径小的C组成正方形,半径大的G构成正四面体,彼此互相穿插构成的笼状化合物;G4C3+是一种以异种原子相邻为主体的平面型阳离子,请分别画出(GC)4、G4C3+的结构示意图。
(5)由(GC)4·G4C3+,其空间构型发生了很大变化。(GC)4是由半径小的C组成正方形,半径大的G构成正四面体,彼此互相穿插构成的笼状化合物;G4C3+是一种以异种原子相邻为主体的平面型阳离子,请分别画出(GC)4、G4C3+的结构示意图。
五、(本题共2小题,共21分)
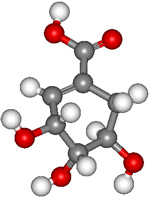
23.(9分)八角茴香属于草本植物,是我国发间常用做烹调的香料。医学研究成果显示,从八角茴香中可以提取到莽草酸,莽草酸有抗炎、镇痛作用,是合成某些抗癌药物的中间体,还是合成“达菲”的前体(“达菲”是对禽流感病毒有一定抑制作用的一种药物)。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)
在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(手性碳原子)。具有手性碳原子的有机物具有光学活性。
请回答下列问题:
(1)观察题中图分子结构模型,写出莽草酸分子中包含的官能团的名称 。
(2)莽草酸跟有机物A在一定条件下发生酯化反应可生成一种相对分子质量为202的酯类物质,写出A可能的结构简式 。
(3)设计通过一步反应使莽草酸分子转化为只有2个手性碳原子的物质的两种方法,有关化学方程式分别为 。
24.(6分)第一个有机化合物Z的全合成是在19世纪由Kolbe完成的,如下图所示,以碳和硫为反应物:
![]()
已知,将足量的NaOH溶液与Z溶液混合后加强热,最后可得到D。X、Y、D均为非极性分子,且Y、D的空间结构相同。
(1)写出X的电子式 ;
(2)写出Y的分子式 ;
(3)写出由Z→D的化学方程式 。
25.(6分)等物质的量的1,2-二溴乙烷和环戊二烯在过量碱的水溶液中与催化剂氯化三乙基苯基铵存在下反应,生成含C 91.3%的烃Y,沸点115℃(1.01×105Pa)。当用一氘代的1,2-二溴乙烷与环戊二烯反应时,只生成唯一产物(已知 具有一定的稳定性)。1molY可与3molBr2在CCl4中反应,求Y的结构与反应所得产物的可能结构(不要求立体化学)。(已知,环丙烷易与Br2反应生成1,3-二溴丙烷)
Y: 产物可能结构: 。
六、(本题共2小题,共19分)
26.(8分)向铝粉中注入混合酸(硫酸和硝酸的混合液),适当加热,使之完全反应,反应中假设还原产物只有NO,NO的体积经测定为21.28L(折算为标准状况)。向反应后的溶液中撒入适量硫酸铵,溶液正好全部结晶(一切损耗都控制在计算误差之内),得到铝铵矾NH4Al2(SO4)2·12H2O晶体453 g。请回答(保留两位小数)
(1)求铝分粉中氧的质量分数。
(2)混合酸中硫酸的质量分数。
27.(11分)将0.45 g A完全燃烧后的产物依次通过盛 有浓硫酸与澄清石灰水洗气瓶,燃烧产物全部被吸收,两个洗气瓶依次增重0.57 g与1.32 g,已知A有六种可能结构,且每种结构中均存在甲基。求A的化学式与其六种可能结构。
(已知: 为同分异构体)