2003年浙江省高中学生化学竞赛试题
考生须知:
⒈全卷分试题和答题卷两部分。试题共有六大题,26小题。满分150分。考试时间120分钟。
⒉本卷答案必须做在答题卷相应位置上,做在试题卷上无效,考后只交答题卷。必须在答题卷上写明县(市)、学校、姓名、准考证号,字迹清楚。
一.选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意,)
1.自英国科学家狄拉克提出反粒子存在的预言,人类开始在茫茫宇宙中寻找反物质的例证。后又聚焦于反物质的合成研究。1997年人类首次合成了9个反氢原子。2002年是人类合成反物质的丰收年,合成了5万个反氢原子,也是对狄拉克诞辰100周年祭典的一份厚礼。你认为反氢原子的组成应该为( )
(A)由1个带负电荷的质子与一个带正电荷的电子构成。
(B)由1个带正电荷的质子与一个带负电荷的电子构成。
(C)由1个不带电荷的中子与一个带负电荷的电子构成。
(D)由1个带负电荷的质子与一个带负电荷的电子构成。
2.环己基氨基酸钙 ![]() 约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。下列溶剂中不能溶解该化合物是( )
约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。下列溶剂中不能溶解该化合物是( )
(A)H2O (B)CH3OH (C)NH3(液) (D)CCl4
3.第ⅢA族A1、Ga均为两性元素,Al(OH)3与Ga(OH)3相比,后者酸性比前者强。当CO2通人NaAlO2和NaGaO2的溶液中,首先沉淀出来的氢氧化物是( )
(A)Al(OH)3 (B)Ga(OH)3 (C)同时沉淀 (D)无法判断
4.2002年10月26日,俄罗斯特种部队在解救歌剧院人质时,使用的气体中可能有芬太奴,芬太奴的结构简式为 ![]() ,它是一种医疗上速效强力镇痛药。下列关于芬太奴的说法不正确的是( )
,它是一种医疗上速效强力镇痛药。下列关于芬太奴的说法不正确的是( )
(A)分子式为:C19H23N2O (B)芬太奴属于芳香族化合物
(C)芬太奴显碱性 (D)芬太奴既能与盐酸反应,又能与热的氢氧化钠溶液反应
5.用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
若按实验原则进行操作,则两者制得单质铜的量为( )
(A)一样多 (B)①多 (C)②多 (D)无法判断
6.已知C-C键可以绕键轴自由旋转,结构简式为![]() 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
(A)分子中至少有9个碳原子处于同一平面上
(B)分子中至少有10个碳原子处于同一平面上
(C)分子中至少有11个碳原子处于同一平面上
(D)该烃属于苯的同系物
7.不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定为世界上最小的温度计。研究人员在长约10-6m,直径为10-7m的碳纳米管中充人液态的金属镓。当温度升高时,管中的镓就会膨胀,通过电子显微镜就能读取温度值。这种温度计测量的范围可从18℃到490℃,精确度较高,所以它可用于检查电子线路是否异常,测定毛细血管的温度等许多方面。根据以上信息判断下列推测中不正确的是( )。
(A)碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计
(B)金属镓的熔点很低,沸点很高
(C)金属镓的体积在10℃至500℃之间随温度变化比较均匀
(D)金属镓的体积在10℃至500℃之间随温度变化很小,可忽略不计
8.A、B是周期表中相邻两主族的两种元素,若A的原子序数为a,以下不可能是B的原子序数是( )
(A)a-17 (B)a-7 (C)a+18 (D)a+19
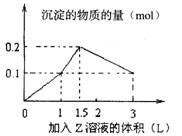 9.1L某混合溶液中,溶质X、Y浓度都为0.1molL-l,向混合溶液中滴加某溶液Z(0.1molL-l氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )。
9.1L某混合溶液中,溶质X、Y浓度都为0.1molL-l,向混合溶液中滴加某溶液Z(0.1molL-l氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )。
(A)氯化铝、氯化铁、氢氧化钠
(B)氯化铝、氯化镁、氢氧化钠
(C)偏铝酸钠、氢氧化钡、硫酸
(D)偏铝酸钠、氯化钡、硫酸
10.在100mL某混合溶液中,c(HNO3):0.4 molL-1,c(H2SO4)=0.1 molL-l,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为( )
(A)0.15m01.L-1 (B)0.225mo1.L-1 (C)0.3mo1.L-1 (D)无法计算
二.选择题(本题包括8小题,每小题4分,共32分。每小题可能有1或2个选项符合题意,若有2个正确选项,只选1个且正确给2分,多选、错选都给0分。)
11.“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用丙炔合成。—甲基丙烯酸甲酯( ![]() )的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是( )
)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是( )
(A)CO和CH3OH (B)CO2和H2O (C)H2和CO (D)CH3OH和H2
12.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4mol Fe(OH)3沉淀,此间共消耗的水的物质的量为( )
(A)8mol (B)10mol (C)11mol (D)12mol
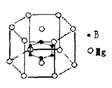 13.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为( )
13.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为( )
(A)Mg14B6 (B)Mg2B
(C)MgB2 (D)Mg3B2
14.下列各溶液中,微粒的物质的量浓度关系正确的是( )
(A)0.1mol L-1的(NH4)2SO4溶液中,c(SO42- )>c(NH4+ )>c(H+)>c(OH-)
(B)0.2m01 L-1的Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
(C)0.1mol L-1的NH4Cl溶液与0.05mol L-l的NaOH溶液等体积混合,c(Cl- ) >c(Na+ ) >c(NH4+ ) >c(OH- ) >c(H+)
(D)c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4C1溶液,
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4C1)
15.据某科学杂志报道,国外有一研究所发现了一种新的球形分子,它的分子式为C60Si60它的分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60、也有Si60结构。下列叙述不正确的是( )。
(A)该物质有很高的熔点、很大的硬度 (B)该物质形成的晶体属分子晶体
(C)该物质分子中Si60被包裹在C60里面 (D)该物质的相对分子质量为2400
16.取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于( )。
(A)8.64g (B)9.20g (C)9.00g (D)9.44g
17.某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H>0
H2(g)+CO2(g) △H>0
当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是( )。
(A)升高温度 (B)加入催化剂
(C)再加入n molCO和n molH2O (D) 再加入2n molCO2和2n molH2
18.已知氢元素有1H、2H、3H三种同位素,氧元素也有16O、18O二种同位素。它们之间形成化合物的种类有( )。
(A)30种 (B)18种 (C)21种 (D)33种
三.(本题共有2小题,共20分)
19.(8分)现有一瓶未知浓度的Ba(OH)2溶液、一瓶未知浓度的H3PO4溶液,还有酚酞试液、pH试纸、试管、胶头滴管等。
(1)请设计一个最佳的实验方案,要求能够简便地判断Ba(OH)2溶液跟H3PO4溶液反应过程中恰好全部生成Ba3(PO4)2。
(2)解释你设计的实验中为什么能判断出恰好全部生成Ba3(PO4)2?
20.(12分)烟草制品燃烧时,所产生的烟雾中存在对人体健康有害的物质包括烟焦油、烟碱(如尼古丁)、CO、烟草生物碱、丙烯醛类、芳香胺、脂肪烯、酚类等一千多种有害物质。下图是检验点燃的香烟烟雾中有害成分的初步方法:
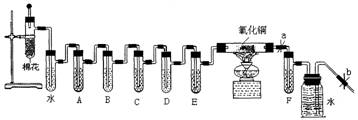
用于检验的试剂有:①乙醇,②澄清石灰水,③饱和NaOH溶液,④酸性高锰酸钾溶液,⑤浓硫酸,⑥银氨液,⑦氯化汞溶液,⑧氧化铜。
(1)将香烟燃烧后的产物进行吸收分析,使燃烧产物依次通过空气冷却、蒸馏水、乙醇……后面的药品顺序由你排定{用序号填入空格}A ,B ,C ,D ,E ,F (尼古丁和丙烯醛成分要单独取样分析)。
(2)要使香烟点燃后继续燃烧而不熄灭,怎样操作能得到保证 :这是依据什么原理使香烟继续燃烧的?
(3)当更换第三支烟后,取出 中的略带黄色的样液5mL于试管中,后加入2mL银氨液放在水浴中加热,写出发生的银镜反应方程式 ;
(4)当燃尽第七支烟后,再取出 中的褐色样液5mL于试管,后向其中滴加数滴HgCl2溶液,产生白色溶液说明有尼古丁。
(5)通过观察硬质试管中的氧化铜颜色是否变化,来证明燃着的香烟产物中有无CO?
有人认为不行,他的理由是 。但是本实验还是能验证燃着的香烟产物中有CO产生的,是通过 装置中实验现象 得以证明。
四.(本题共2小题,共20分)
21.(10)据报道,2002年某市一辆满载砒霜的大货车翻下山坡,少量砒霜散落河水中。有关部门紧急采取措施。已知砒霜的化学式为:As2O3,剧毒,在低温下微溶于水,溶于水后生成亚砷酸,亚砷酸为三元弱酸。请回答下列问题:
(1)有关部门采取措施中加入一种物质。这种物质是 (写名称),写出与亚砷酸在水中反应的化学方程式 。
(2)古时确定人是否是砒霜中毒死亡,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀H2SO4,得到一种气体A。加热A,在试管中得到砷镜。写出上述两个化学方程式 、 。
(3)砒霜与面粉、淀粉、味精及小苏打极其相似,容易误食中毒,急救方法之一是,立即将中毒者移离现场,灌服氢氧化铁胶体或悬浊液(12%硫酸亚铁溶液与20%氧化镁等量混合)并进行催吐,写出制备氢氧化铁胶体或悬浊液的反应原理(用方程式表示) 。经过上述催吐后再进一步药物处理,即可得救。
22.(10分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)请比较B2A4、C2A4、E2A4三种化合物的沸点由高到低的顺序 。
(2)从给定的元素中选出若干种组成化合物,写出相对分子质量最小的离子化合物的化学式 ;
(3)从题中元素为选择对象,写出不少于三种炸药的化学式或名称 、 、 。
(4)有人设想某种分子式为C4N4O8的物质(该物质中同种原子的化学环境完全相同)是一种威力极强的炸药,请推测它的结构简式。
五.(本题共2小题,共14分)
23.(8分)脂肪烃(CxHy)分子中碳碳原子间共用电子对数为 (用x、y代数式表示),若某脂肪烃分子中碳碳原子间的共用电子对数为26,且分子中含有一个双键一个叁键,则它的化学式为 。若将Cx看作烃完全失去氢原子后的产物,则球碳C70中的碳碳原子间的共用电子对数为 。
 24.(6分)青蒿素是我国科学家从青蒿中提取的一种治疗疟疾的有效成分。下图是某研究室通过晶体衍射测定得到的有关青蒿素分子结构中一些主要共价键的键长数据,图中元素符号左下角的数字是相应原子的编号,数据是相应键长(键长的单位是pm)。
24.(6分)青蒿素是我国科学家从青蒿中提取的一种治疗疟疾的有效成分。下图是某研究室通过晶体衍射测定得到的有关青蒿素分子结构中一些主要共价键的键长数据,图中元素符号左下角的数字是相应原子的编号,数据是相应键长(键长的单位是pm)。
(1)写出青蒿素的分子式 。
(2)试分析在青蒿素分子中,写出分子中可能是双键的原子及编号 。
六.(本题共2小题,共24分)
25.(10分)实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13%I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为: SO32-+I2+2HCO3-===SO42-+2I-+2CO2↑+H2O
②取①中所得的水溶液,加人一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。离子方程式为:6H++IO3-+5I-===3I2+3H2O
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 molL-1 Na2S2O3 15.10mL。离子方程式为: I2+2S2O32-===2I-+S4O62-
回答下列问题;
(1)写出②、③三步操作中所发生反应的离子方程式。
② ,③ 。
(2)①中为什么要用0.13%I2的氯仿溶液,而不直接用I2的水溶液? 。
(3)计算样品中亚硫酸钠的质量百分含量。
26.(14分)有许多现象,你去留心观察,分析思考,会发现一些有趣问题,从中发现规律。如下系列芳香族有机物,各项排列构成一个等差数列。请回答有关问题:
![]()
(1)写出上面等差数列的第n项芳烃分子式。
(2)某课外兴趣小组,做了系列实验。他们将该数列的前五项芳烃逐一加到浓的酸性高锰酸钾溶液中加热。结果发现,只有A1无明显变化,其余四种物质都能使酸性高锰酸钾溶液褪色。经分析知,后四种的氧化产物是![]() 或者两者都有。由此你能得出什么结论?
或者两者都有。由此你能得出什么结论?
(3)甲、乙、丙三同学同做酸性高锰酸钾溶液氧化A5的实验。甲将氧化后的混合液酸化分离得到一种无色晶体X,称取0.2540gX,用热水配成100mL溶液,取出25mL用0.1mol L-1NaOH溶液中和滴定,滴到10mL时达到终点;丙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体Y,中和测定知Y的中和能力比X的中和能力弱得多;乙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体,经分析其中包含了甲与丙获得的两种成份。通过计算确定X的结构简式。
(4)仔细分析该系列芳烃的二氯取代物异构体的数目,很有规律性。请你分析推出An的二氯取代物种数的代数表达式。

