高一(上)化学期末考试试题(B卷)
一、选择题
1.实验室制下列各组气体,所用气体发生装置相同的是( )
A.氢气和二氧化碳 B.氢气和氧气 C.氯气和氧气 D.氯气和氢气
2.钠在空气中发生变化的过程为( )
A.Na→Na2O2→NaOH→Na2CO3·10H2O→Na2CO3 B.Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
C.Na→Na2O2→NaOH→Na2CO3·10H2O→HaHCO3 D.Na→Na2O→NaOH→Na2CO3·10H2O→NaHCO3
3. 将一小块金属钾投入一列物质的水溶液中,既能生成气体,又能生成沉淀的是( )
A.NH4Cl B.MgSO4 C.FeCl3 D.BaCl2
4.若碳酸锂与碳酸钡的混合物与碳酸钙的质量相等,且跟盐酸反应放出CO2的量也相等时,碳酸锂与碳酸钡的质量比是( )
A.5:7 B.7:5 C.2:1 D.1:2
5.超氧化钾(KO2)与CO2反应生成K2CO3和O2,则反应中被氧化的原子与被还原的原子数目之比是
A.1:1 B.1:3 C.3:1 D.8:17
6.LiH是一种氢气发生剂,用于军事或其他需氢气的场合。反应为:
LiH+H2O![]() LiOH+H2↑在这个反应中( )
LiOH+H2↑在这个反应中( )
A.水是氧化剂,LiH是还原性 B.LiH是氧化剂,水是还原剂
C.LiH既是氧化剂又是还原剂 D.该反应是非氧化还原反应,不存在氧化剂和还原性
7.下列离子方程式错误的是( )
A.钠投入硫酸铜溶液中: 2Na+Cu2+![]() 2Na++Cu
2Na++Cu
B.碳酸钙与盐酸反应: CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
C.硫酸与氢氧化钡反应: SO42-+Ba2+![]() BaSO4↓
BaSO4↓
 D.氯气通入水中:Cl2+H2O
D.氯气通入水中:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
8.在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水碳酸钠,搅拌后静置,最终所得晶体的质量是( )
A.等于10.06g B.大于1.06g小于2.86g
C.等于2.86g D.大于2.86g
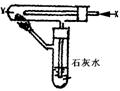
9.按右图装置持续通入X气体,并在管口点燃,实验结果使澄清的石灰水变浑浊,则X、Y可以是( )
A.H2和NaHCO3 B.CO和Na2CO3
C.CO和CuO D.H2和Fe2O3
10.将100mL 0.6mol/L的盐酸和等体积0.4mol/L的Ba(OH)2溶液混合后,所得混合液的体积为二者之和,则混合液中OH-离子物质的量浓度是( )
A.0.4mol/L B.0.2mol/L C.0.1mol/L D.0.05mol/L
11.金属R的氧化物相对分子质量为M1,氧化物相对分子质量为M2,则此金属元素的化合价可能是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.标准状况下有O2和Cl2组成的混合气体共500mL,通入H2,使其恰好完全燃烧,用水吸收,得250mL溶液。从中取出25mL,用0.125mol/L NaOH 20mL恰好中和,则与混合气体反应的H2的体积为( )
A.280mL B.440mL C.500mL D.720mL
13.将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量的氯气,充分反应后将溶液蒸干得到11.175g固体,则原混合物溶液中K+、Cl-、Br-的物质的量浓度之比为( )
A.3:2:1 B.1:2:3 C.1:3:2 D.2:3:1
14.把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300mg,则该氯化镁中的杂质可能是( )
A.NaCl B.AlCl3 C.KCl D.CaCl2
15.下列物质能使紫色石蕊试液由紫变红又褪色的是( )
①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉溶液 ⑤木炭
A.①②③ B.①③④ C.②③④ D.①③④⑤
16.下列物质见光易分解的是( )
①溴化银 ②氟化钙 ③氯水 ④漂白粉 ⑤碘化钾 ⑥碘化银
A.①②③ B.④⑤⑥ C.①③④ D.①③⑥
17.使用淀粉—KI试纸可以区别的一组物质是( )
A.碘水和溴水 B.溴水和氯水 C.KBr溶液和KCl溶液 D.氯水和KCl溶液
18.下列说法正确的是( )
A.被氯气漂白的物质不稳定,受热见光可恢复原色
B.游泳池中加漂白精主要起漂白作用
C.市售的含碘食用盐中碘元素以KIO3形式存在
D.目前海水淡化的方法主要是蒸馏法
19.同温同压下某烧瓶充满氧气时,质量为116g,充满二氧化碳时质量为122g,充满某气体时质量为114g,则某气体的相对分子质量是( )
A.28 B.60 C.32 D.44
20.相同质量的下列物质,分别加入足量盐酸后产生气体最多的是( )
A.K2CO3 B.NaHCO3 C.MgCO3 D.Ba(HCO3)2
21.在一定体积的容器内,加入1.5mol氙气和7.5mol氟气,于400℃和2633kp压强下,加热数小时,然后迅速冷至25℃,容器内除得一种晶体外,还余4.5mol氟气,则所得无色晶体产物中氙与氟的原子个数比为( )
A.1:2 B.1:3 C.1:4 D.1:6
22.向5mL NaCl溶液里滴入一滴AgNO3,出现白色沉淀,继续加入1 滴碘化钾溶液,沉淀变为黄色,再加入一滴硫化钠溶液,沉液又变成黑色,根据上述变化过程分析此三种沉淀的溶解度关系为( )
A.AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D.无法判断
二、填空题
23.呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2,也可起到同样的作用。(1)写出KO2与CO2反应的化学方程式
(2)2kg Na2O2与1kg KO2分别和CO2反应,生成的O2质量比为
(3)等质量的CO2分别与足量Na2O2、KO2反应生成的O2质量比为
(4)你认为选用 作补氧剂更为合适,理由是
24.用金属钠制取Na2O通常采用下面的方法: 2NaNO2+6Na![]() 4Na2O+N2↑
4Na2O+N2↑
方程式中NaNO2是亚硝酸钠,试说明不采用钠在空气中燃烧的方法而采用此法制取Na2O的原因
25.取2g干铝粉和3g干碘小心混匀,往混合物上加0.5g水,发生剧烈反应。
(1)铝和碘反应的化学方程式为
(2)铝和碘反应看到的现象是
(3)铝和碘反应中,水起到的作用是
26.用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应时,所用AgNO3溶液的体积比为 。如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应时,所用三种溶液的体积比为
三、推断题
27.根据下图所示的转化关系及实验现象,推断A~Y物质的化学式
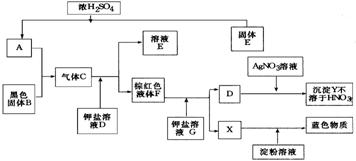
A B C D
E F G X
Y
四、实验题
28.下列有关实验操作正确的是( )
A.如果滴定管尖嘴部分有气泡,应快速放液,把气泡赶走
B.物质溶解后,立即转移到容量瓶中
C.读滴定管的液面读数时,应当平视,读取液体凹液面与刻度线相切处的读数
D.酸式滴定管滴液时左手拿锥形瓶,右手控制活塞
29.过碳酸钠和盐酸反应的化学方程式为:
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母): 。
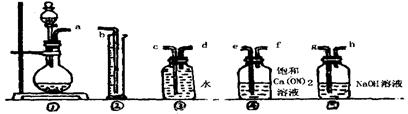
(2)装置④的作用:
。
(3)如果实验时,称取wg样品和过量盐酸反应后,没得氧气的体积(标准状况)为VmL,则此样品的纯度为 。
(4)某次实验,称取0.9g样品进行测定,实验室有50mL,100mL,150Ml三种规格的量筒,应选用规格为 的量筒进行实验。
五、计算题
30.20℃时,Na2CO3和NaHCO3的溶解度分别是21.5g和9.6g,向100g20℃饱和Na2CO3溶液中通入足量CO2,最多可得多少g晶体?(温度20℃)
31.将4mgCl2和mg磷点燃反应后不剩余反应物,即反应物完全转化为生成物。
(1)试用过量计算说明生成物有什么?
(2)计算生成物的物质的量之比。
一、(28分 )1.A(1分)
2.B(1分) 3.BC(2分) 4.B(1分)
5.C(1分) 6.A(1分) 7.AC(2分) 8.D(1分)
9.AC(2分) 10.C(1分) 11.AD(2分)
12.D(1分) 13.A(1分) 14.B(1分)
15.B(1分) 16.D(1分) 17.D(1分)
18.CD(2分) 19.A(1分) 20.BC(2分)
21.C(1分) 22.C(1分) 二、(20分)23.(1)4KO2+2CO2![]() 2K2CO3+3O2↑ (2)0.61:1 (3)1:3 (4)KO2 KO2放出O2效率高于Na2O2
24.Na在空气中燃烧生成Na2O2,用此法可制得Na2O,并且生成的N2可保护Na2O不被氧化成Na2O2 25.(1)2Al+3I2
2K2CO3+3O2↑ (2)0.61:1 (3)1:3 (4)KO2 KO2放出O2效率高于Na2O2
24.Na在空气中燃烧生成Na2O2,用此法可制得Na2O,并且生成的N2可保护Na2O不被氧化成Na2O2 25.(1)2Al+3I2![]() 2AlI3
(2)出现紫色蒸气 (3)催化剂 26.1:2:3, 6:3:2三、(18分)27. HCl MnO2 Cl2 KBr
KCl Br2 KI I2 AgBr
2AlI3
(2)出现紫色蒸气 (3)催化剂 26.1:2:3, 6:3:2三、(18分)27. HCl MnO2 Cl2 KBr
KCl Br2 KI I2 AgBr
四、28.AC 29.(1) a g h e f d c b (2)检验CO2是否完全被吸收
(3)![]() (4)100mL
(4)100mL
五、(16分)30. 20.44g 31.(1)PCl3和PCl5 (2)107:35