高二化学期中试卷2
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分,每题只有一个选项符合题意)
![]() 1. 已知4NH3+5O2
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、
1. 已知4NH3+5O2
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、
υ(H2O) [mol/(L·s)]表示,下列关系式正确的是( )
A.4υ(NH3) =5υ(O2) B. 5υ(O2)=6υ(H2O)
C.2υ(NH3) =3υ(H2O) D. 4υ(O2)= 5υ(NO)
2.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) ![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
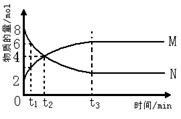 3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
下列表述中正确的是( )
A.反应的化学方程式为:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M的浓度的2倍
4. 下列叙述中,能说明某物质是弱电解质的是( )。
A. 熔化时不导电 B. 溶液中有已电离的离子和未电离的分子共存
C. 水溶液的导电能力很弱 D. 不是离子化合物,是极性共价化合物
5. 下列溶液一定呈碱性的是( )。
A. 溶液中[![]() ] > [
] > [![]() ]
B.
溶液中含有
]
B.
溶液中含有![]() 离子
离子
C. 滴加甲基橙后溶液显红色 D. 滴加甲基橙后溶液显黄色
6.在氯化铵溶液中,下列关系式正确的是 ( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(H+)=c(OH-) D.c(NH4+)=c(Cl-)>c(H+)>c(OH-)
7.相同物质的量的下列溶液,碱性最强的是 ( )
A.Na2CO3 B.NaNO3 C.Na2SiO3 D.Na2SO3
8.定温时将pH=2的盐酸和醋酸分别稀释到pH=3时,所稀释时用水的体积前者与后者的关系是( )
A.大于 B.小于 C.等于 D.不能确定
二.选择题(本题共10小题,每小题4分,共40分,每小题可能有1—2个选项符合题意)
9.在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当是
A.a中大 B.b中大 C.a、b中一样大 D.无法判断
10.在一个容器为VL的密闭容器中,放入2LA(g)和1LB(g),在一定条件下发生下列反应:3A(g)+B(g) ![]() nC(g)+2D(g),达到平衡后,A和物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是 ( )
nC(g)+2D(g),达到平衡后,A和物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是 ( )
A.1 B.2 C.3 D.4
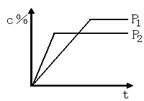 11. 对于达到平衡的反应:2A(g)+B(g)
11. 对于达到平衡的反应:2A(g)+B(g) ![]() nC(g),符合下图1所示的结论是 ( )
nC(g),符合下图1所示的结论是 ( )
A. P1>P2,n>3 B. P1>P2,n<3
C. P1<P2, n>3 D. P1<P2, n<3
12.下列事实不能用勒夏特列原理解释的是 ( )
A.H2S水溶液中加碱有利于S2-的生成 B.工业制硝酸时,加入催化剂有利于氨的氧化
C.高压有利于合成氨反应 D.500℃比室温更有利于合成氨的反应
13.一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时, C的浓度为原来的1.9倍,下列说法错误的是
(
)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时, C的浓度为原来的1.9倍,下列说法错误的是
(
)
A. m+n>p B.平衡向逆反应方向移动 C. A的转化率降低 D. C的体积分数增加
14.若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A. Al3+、Na+ 、NO3-、Cl- B. K+、Na+、NO3-、Cl-
C. K+、Na+、AlO2-、Cl- .D. K+、NH4+、NO3-、SO42
15.某种一元酸(HA)溶液,加入一种强碱(MOH)溶液,反应后溶液呈中性,下列判断正确的是 ( )
A.所用酸一定过量 B.生成的盐一定不水解
C.酸与碱一定等物质的量混合 D.反应后溶液中必存在[A-]=[M+]
16.将标准状况下体积为2.24LCO2缓缓通入100mL1mol/LNaOH溶液中(溶液体积变化忽略不计),反应结束后,溶液中有关离子物质的量浓度的关系正确的是( )
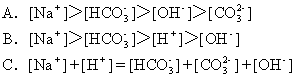
![]()
17.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
18.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:
X(g)+aY(g) ![]() bZ(g) 反应达到平衡后,测得X的转化率为50%。而且,在 同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可有是
( )
bZ(g) 反应达到平衡后,测得X的转化率为50%。而且,在 同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可有是
( )
A.a=1,b=1 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
选择题答题卡(共72分)
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 序号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共78分)
三、(本题包括4小题,共35分)
19.(6’)简述80℃时纯水的pH小于7的原因。
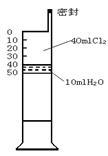
20.(9’)已知氯水中有如下平衡:Cl2+H2O
![]() HCl+HClO.
HCl+HClO.
常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,
针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
(1)针筒中可能观察到的现象是____________________
(2) 若将此针筒长时间放置在有日光的地方,最终可能
观察到的现象是_________________________________.
(3)用化学平衡的观点解释现象(2)__________________.
_________________________________.
21.(8’) PH值相等,且等体积的醋酸和盐酸与足量的Zn反应,起始速率醋酸 盐酸,放出的H2的量醋酸 盐酸(填>,<或=,下同);物质的量浓度相等,且等体积的醋酸和盐酸与足量的Zn反应,起始速率醋酸 盐酸,放出的H2的量醋酸 盐酸。
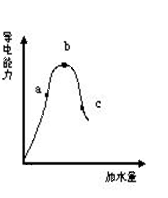 22.(12’)一定温度下,冰醋酸加水稀释过程导电能力如图所示,则:(1)“O”点为何不导电?
22.(12’)一定温度下,冰醋酸加水稀释过程导电能力如图所示,则:(1)“O”点为何不导电?
。
(2)a、b、c三点的pH值由大到小的顺序是
(3)a、b、c三点中CH3COOH的电离程度最大的一点是 点
(4)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取
(填标号) A.加热 B.加浓醋酸
C.加入固体KOH D.加水 E.加固体CH3COONa F.加Zn粒
四.(本题包括2个小题,共27分)
23.(15’)有标准氢氧化钠溶液滴定待测盐酸的有关问题:
(1)盛放待测盐酸的锥形瓶下方垫一张纸的作用是______________________________。
(2)用酚酞作指示剂,滴定到达终点时,溶液颜色变化是________________________。
(3)下列错误操作:①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准氢氧化钠溶液。②用酸式滴定管取用待测液前,尖嘴部分有气泡,取用过程中气泡消失。③滴定前,读碱液体积时视线低于碱式滴定管中的液面,滴定后读碱出碱液体积时,视线高于碱式滴定管的液面。④锥形瓶用待测酸液润洗两次。
哪些错误操作会使盐酸浓度的测定值偏低?________________________;
哪些错误操作会使盐酸浓度的测定值偏高?________________________。
(4)如果用甲基橙代替酚酞作指示剂,此时所得盐酸浓度的测定值比用酚酞作指示剂测出的稍大还是稍小?___________。
![]() 24(12’)对于可逆反应:mA(g)+ nB(g)
pC(g) + qD(g)达平衡时,V正=k1[A]m[B]n
24(12’)对于可逆反应:mA(g)+ nB(g)
pC(g) + qD(g)达平衡时,V正=k1[A]m[B]n
(K1为速率常数),达平衡时,K2 = { c(C)} p ×{ c(D)}q (K2为化学平衡常数),
{ c(A)}m ×{ c(B)}n
且K1、K2只与温度有关。现将4molSO2与2molO2充入为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。
则:⑴起始时正反应速率是平衡时的 倍。
⑵500℃时,该反应的平衡常数K2是
![]() ⑶在温度不变时,再向平衡体系中加入2molSO2 、2molO2与4molSO3,平衡将向 移动。五. (本题包括2小题,共16分)
⑶在温度不变时,再向平衡体系中加入2molSO2 、2molO2与4molSO3,平衡将向 移动。五. (本题包括2小题,共16分)
25.(6’)某温度时,把1molN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应达平衡,这时容器内压强为开始时的1.8倍,则
(1)前4s以lN2O4浓度变化表示的平均反应速率为
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含NO2 mol
26.(10’)50 mL PH = 1的稀H2SO4和盐酸的混合液与50 mL Ba(OH)2溶液相混合,充分反应后过滤,得0.466 g沉淀,滤液的PH值变为13。求:
(1)原混合液中SO![]() 和Cl
和Cl![]() 的物质的量
的物质的量
(2)Ba(OH)2溶液的物质的量浓度