高二化学期中试卷2
可能用到的相对原子质量:H—1,O—16,S—32
第一卷 选择题(75分)
一、 选择题(每题只有一个正确答案,共3’×10=30’)
1. 氮气能大量存在于空气中,且能维持含量基本稳定的主要原因是
A.氮分子结构稳定 B.氮气难溶于水
C.氮分子是非极性分子 D.氮气比空气轻
2. 关于硝酸的叙述中不正确的是
A.浓硝酸与浓盐酸一样,在空气中出现白雾
B.硝酸见光分解和受热分解产物相同,都是NO2、O2和H2O
C. NO2与水反应有硝酸生成,所以NO2是硝酐
D.硝酸与金属反应,既表现出氧化性,又表现出酸性
3.下列含氧酸的酸性由强到弱的顺序正确的是
A.HNO3>H2SiO3 B.H3PO4>H2SO4
C.H3AsO4>H3PO4 D.H2SO4>HClO4
4.铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是
A.FeSO4 B.Na2CO3 C.KNO3 D.KCl
5.在酸性条件下,下列各组离子不能大量其存的是
A.K+、NO3-、Cl-、Na+ B.K+、SO32-、Cl‑、NO3-
C.Na+、Cu2+、NO3-、SO42- D.Na+、SO42-、Cl-、H+
6. 反应4NH3(g)+5O2(g) = 4NO(g)+6H2O在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为
A、v(NH3)=0.010 mol/(L·S) B、v(O2)=0.0010 mol/(L·S)
C、v(NO)=0.0010 mol/(L·S) D、v(H2O)=0.045 mol/(L·S)
![]() 7. 一定温度下,在密闭容器中发生反应:A(g)+3B(g) 2C(g)达到平衡的标志是
7. 一定温度下,在密闭容器中发生反应:A(g)+3B(g) 2C(g)达到平衡的标志是
A、C生成的速率与C分解的速率相等
B、单位时间生成n molA, 同时生成3n molB
C、 C、A、B、C的浓度相等
D、D、A、B、C的分子数比为1:2:3
![]()
![]() 8. 设C+CO2 22CO(正反应为吸热反应)反应速率为v1,设N2+3H2 2NH3(正反应为放热反应)反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
8. 设C+CO2 22CO(正反应为吸热反应)反应速率为v1,设N2+3H2 2NH3(正反应为放热反应)反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A、同时增大 B、同时减小 C、v1增大,v2减小 D、v2增大,v1减小
9. 综合化学反应速率和化学平衡考虑,合成氨应采用的条件是
A、低温、高压、催化剂 B、低温、低压、催化剂
C、高温、高压、催化剂 D、适宜高温、高压、催化剂
10.
在3NO2(g)+H2O(g)![]() 2HNO3(l)+NO(g)(正反应为放热反应)反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
2HNO3(l)+NO(g)(正反应为放热反应)反应达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
二、 选择题(每题有1~2个正确答案,3’×15=45’)
11. 一定温度下,在固定容积的密闭容器中,可逆反应:
![]() mA(气)+nB(气) pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
mA(气)+nB(气) pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
A.只有③④ B.②③④ C.①②③④ D.①②③④⑤
12.取三张蓝色石蕊试纸放在表面皿上,然后按顺序分别滴加98%H2SO4、 69%HNO3、新制氯水,这三张试纸最后呈现的颜色分别是
A.白、黑、白 B.红、黑、白 C.黑、白、白 D.红、红、红
13. 从下列事实,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,工业生产中采取500℃的措施
14. 下列反应中,既表现硝酸的氧化性,又表现了硝酸的酸性的是
A. CuO+HNO3 B.Cu+HNO3(浓)
C.Fe(OH)2+HNO3 D.C+HNO3(浓)
15. 用以下三种途径来制取相同质量的硝酸铜:1铜与浓硝酸反应;2铜与稀硝酸反应;3铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
A. 所消耗的硝酸的量:①>②>③
B.对环境造成的危害,③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量不相等
16.
将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
![]() 17. 一定温度时于密封容器中发生反应:mA(g)+nB(g) pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是
17. 一定温度时于密封容器中发生反应:mA(g)+nB(g) pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是
A.平衡向正反应方向移动 B.C气体的质量分数增大
C.气体A的转化率降低 D.m+n>p
![]() 18. 反应2HI(气) H2(气)+I2(气)(正反应为吸热反应),在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
18. 反应2HI(气) H2(气)+I2(气)(正反应为吸热反应),在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
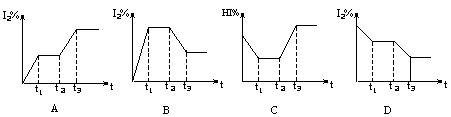
![]()
 19. 已知某可逆反应:mA(气)+nB(气) xC(气) (正反应为放热反应),在密闭容器中进行,右图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
19. 已知某可逆反应:mA(气)+nB(气) xC(气) (正反应为放热反应),在密闭容器中进行,右图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
A.T1>T2 ,P1>P2 ,m+n>x ,正反应为放热反应
B.T1<T2 ,P1<P2 ,m+n<x ,正反应为吸热反应
C.T1>T2 ,P1<P2 ,m+n<x ,正反应为放热反应
D.T1<T2 ,P1>P2 ,m+n>x ,正反应为吸热反应
20. 氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的
是:
A、Na3N与水的反应是非氧化还原反应
B、Na3N 是共价化合物
C、Na3N若与足量盐酸作用可生成两种盐
D、Na3N中钠离子半径大于氮离子半径
21. Na2C2O4能被高锰酸钾氧化生成二氧化碳。实验测知每生成1120mL(标准状况)二氧化碳需消耗100mL 0.1mol/L的高锰酸钾溶液,则反应后的锰元素的化合价为: A、+6 B、+4 C、+2 D、无法确定
22. 在铜跟稀硝酸的反应中,如果有1mol硝酸被还原了,则被氧化的铜的物 质的量为
A、3mol B、8/3mol C、3/8mol D、3/2mol
23. 亚磷酸(H3PO3)是由PCl3和水反应生成的。已知:a.H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;b.H3PO3与碘水反应,碘水褪色,再加AgNO3溶液有黄色沉淀生成;c.H3PO3中加AgNO3溶液,有黑色Ag沉淀,并有红棕色气体产生。根据以上叙述,H3PO3是:①强酸②弱酸③二元酸④三元酸⑤氧化性酸⑥还原性酸。其中正确的是:
A、②④⑥ B、①④⑤ C、②③⑤ D、②③⑥
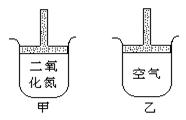 24. 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:
24. 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:
① 将两容器置于沸水中加热
② 在活塞上都加2千克的砝码。
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙
25. 密闭容器中发生反应:X2 (g)+ Y2(g) = 2Z(g),已知X2、Y2、Z的起始量分别为0.1mol、0.3 mol、 0.2 mol,一定条件下达到平衡时,各组分的物质的量有可能是
A、Z为0.3 mol B、Y2为0.35 mol C、X2为0.2 mol D、Z为0.4 mol翰林汇
高二化学期中试卷
![]()
 选择题答题框:
选择题答题框:
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
第二卷 非选择题(共75分)
三、填空题:(52分)
26.(5分)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
⑴□NaIO3+□NaHSO3 =□NaHSO4+□Na2SO4+□I2+□H2O
⑵已知含氧酸盐的氧化作用随溶液酸性的增强而增强。在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-生成的量,发现开始阶段反应速率呈现递增的趋势。试简述这变化趋势发生的原因: 。
 27.(14分)、将红热的黑色固体单质甲放入一黄色的溶液乙中,充分反应后,产生由两种气体组成的混合气体A,A在常温下不与空气作用,将A做如下的实验:
27.(14分)、将红热的黑色固体单质甲放入一黄色的溶液乙中,充分反应后,产生由两种气体组成的混合气体A,A在常温下不与空气作用,将A做如下的实验:
⑴ 推断各物质的化学式:甲:__________;乙:__________;丙:__________;
A:__________;B:__________; C:__________。
⑵写出甲与乙反应的化学方程式:_____________________________。
28.(6分)在缺氧的条件下,砷化氢受热分解能形成亮黑色的“砷镜”,砷镜能被次氯酸溶液所溶解,其中生成物之一是砷酸,请写出这两个变化的化学方程式。
(1)
(2)
![]() 29.(14分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随时间(min)的变化情况如下表:
29.(14分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随时间(min)的变化情况如下表:
| 实验序号 |
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
⑴在实验1,反应在10-20 min时间内以A的浓度变化表示的平均速率为
mol/(L﹒min)。
⑵在实验2中,A的初始浓度C2= mol/L,反应经20分钟达到平衡,可推测实验2中还隐含的条件是 。
⑶实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、<、=),且C3 1.0 mol/L(填>、<、=)。
⑷比较实验4和实验1,可推测该反应的正反应是 反应(选填吸热、放热)。理由是 。
30. (8分) 将等物质的量的A、B、C、D四种物质混合,发生如下反应:
![]() aA + bB c
C + d D(g)。
己知生成物C是固体,当反应进行一段时间后,测得A减小了n mol ,B减少了n/2 mol ,C增加了3n/2 mol ,D增加了 n mol ,此时反应达到平衡。(1)该反应的化学方程式中各物质的化学计量数是:
aA + bB c
C + d D(g)。
己知生成物C是固体,当反应进行一段时间后,测得A减小了n mol ,B减少了n/2 mol ,C增加了3n/2 mol ,D增加了 n mol ,此时反应达到平衡。(1)该反应的化学方程式中各物质的化学计量数是:
a = , c = 。
(2)如果只改变压强,反应速率发生变化,但平衡不发生移动,则反应中各物质的聚集状态是A , B 。
(3)如果只升高温度,反应一段时间后,测知这四种物质的量相等。则该正反应是
热反应。
31.(5分)某温度下,在1L密闭容器中反应N2+3H2![]() 2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
(1)若X=0,Y=0,Z= 。
(2)若X=0.75,Y= ,Z= 。
(3)X、Y、Z应该满足的一般条件(用两个联立方程表示)
或 。
四.实验题(10分):
32.(10分)如上图所示,实验室用NH4Cl和Ca(OH)2制取干燥的NH3 。试回答下列问题:
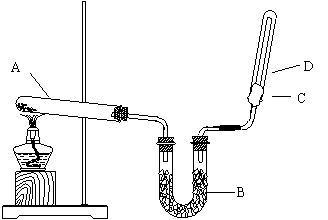
(1)画出NH3的电子式 。
(2)B处的药品是 。
(3)检验D处试管中NH3是否收集满,除用湿润的红色石蕊试纸外,还可采用什么简易方法。
(4)试举出实验室制取NH3的另外一种方法(不同反应类型和装置类型)
(5)在标准状况下,收集满一试管NH3后,将该试管放入水中,水上升充满试管,则试管中溶液的物质的量浓度为 。
五、计算题(13分)
33.(5分)某工厂每天要烧掉含硫1.6%的烟煤100t,排出的SO2严重地污染环境。如果变废为宝,把这些SO2回收利用,那么,在理论上每年(以360天计算),可生产98%的浓硫酸多少吨?
34.(8分)在500℃压强为1.01×105Pa 时,将2体积SO2和1体积O2的混合气体,通入一个装有催化剂的恒容密闭容器,结果能得到含91%(体积组成)SO3的混合气体,此时容器内反应物和生成物的浓度不再发生变化。
求:(1)此时混合物中SO2和O2的体积分数各为多少?
(2)计算SO2的转化率。
⑶求反应后容器的压强。