高二化学期中试题(文科)A
班级________ 姓名________ 分数________
原子量 H—1 N—14 O—16 Na—23 S—32 Cl—35.5 Cu—64 Fe—56
一、选择题(有1—2个选项符合题意)
1.下列中,造成光化学烟雾的主要气体是( )
A.![]() B.CO C.
B.CO C.![]() D.
D.![]()
2.下列气体只能用排空气法收集的是( )
A.![]() B.NO C.
B.NO C.![]() D.
D.![]()
3.下列各物质属于强电解质的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4.下列溶液碱性最强的是( )
A.滴加石蕊变红的溶液 B.![]() 的溶液
的溶液
C.![]() 的溶液 D.
的溶液 D.![]() 的氢氧化钡溶液
的氢氧化钡溶液
5.下列各反应式,表示水解反应的是( )
A.![]()
![]()
![]()
B.![]()
![]()
![]()
C.![]()
![]()
![]()
D.![]()
![]()
![]()
6.下列物质水溶液中,pH大于7的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
7.下列方法可用于实验室制氨气的是( )
A.在浓氨水中加固体NaOH并微热
B.在氢氧化钠稀溶液中滴加氯化铵溶液
C.加热消石灰和氯化铵的固体混合物
D.加热分解氯化铵晶体
8.把三氯化铁溶液蒸干并灼烧,最后得到的固体是( )
A.无水三氯化铁 B.氢氧化铁
C.四氧化三铁 D.三氧化二铁
9.相同物质的量浓度的下列溶液:①NaOH ②![]() ③
③![]() ④NaCl ⑤HCl,溶液中
④NaCl ⑤HCl,溶液中![]() 由小到大排列正确的是( )
由小到大排列正确的是( )
A.③④①②⑤ B.①②④③⑤
C.⑤③④②① D.①②③④⑤
10.一个5升的密闭容器里盛有7 mol某气态反应物,5 min后测得这种气态反应物还剩余5.8 mol,以这种物质表示的反应速率为( )
A.0.048 mol /(L·min) B.0.28 mol /(L·min)
C.1.16 mol /(L·min) D.0.232 mol /(L·min)
11.在盐类水解过程中,下列叙述一定正确的是( )
A.盐的电离平衡被破坏 B.水的电离平衡被破坏
C.![]() 增大 D.
增大 D.![]() 增大
增大
12.20 mL、1 mol/L醋酸溶液与40 mL、0.5 mol/L NaOH溶液相混合,所得溶液中离子浓度由大到小的排列顺序正确的是( )
A.![]()
B.![]()
C.![]()
D.![]()
13.下列化学反应中,水有电子转移的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
14.下列可逆反应达平衡时,增大压强或降低温度使平衡移动方向一致的是( )
A.![]()
![]() 2HI(g)(正反应放热)
2HI(g)(正反应放热)
B.![]()
![]()
![]() (正反应吸热)
(正反应吸热)
C.![]()
![]() HCl(g)+HCl(3g)(正反应吸热)
HCl(g)+HCl(3g)(正反应吸热)
D.![]()
![]()
![]() (正反应放热)
(正反应放热)
15.下列离子方程式书写正确的是( )
A.醋酸和氢氧化钠溶液反应 ![]()
![]()
![]()
B.金属钠与水反应 ![]()
![]()
![]()
C.![]() 溶液与过量的盐酸反应
溶液与过量的盐酸反应 ![]()
![]()
![]()
D.碳酸氢钠水解 ![]()
![]()
![]()
二、填空题
1.写出下列化合物中氮元素显示的化合价:![]() ________,
________,![]() ________,
________,![]() ________,
________,![]() ________,
________,![]() ________,
________,![]() ________,
________,![]() ________.
________.
2.写出氮气分子的电子式________;氮气通常很稳定,但特定条件下可被氧气氧化,也可被![]() 还原,写出这两个方程式______________________________________________
还原,写出这两个方程式______________________________________________
______________________________________________________________________________.
3.□![]() □HCl(浓)
□HCl(浓)![]() □
□![]() □KCl+□
□KCl+□![]() □
□![]()
氧化剂是________,还原剂是________,电子转移总数为________.
4.在一定条件下,向密闭容器内通入![]() 和
和![]() ,发生反应:
,发生反应:![]()
![]()
![]() (正反应为放热反应),达到平衡后,
(正反应为放热反应),达到平衡后,
(1)将混合气体积缩小一半,则容器内压强将会________;平衡向________移动,其原因是_______________________________________________________________________.
(2)再通入![]() 气,则容器内压强将会________,平衡向________移动,其原因是___________________________________________________________________________.
气,则容器内压强将会________,平衡向________移动,其原因是___________________________________________________________________________.
(3)升高温度,平衡向________移动,其原因是_____________________________.
5.常温下,在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种溶液中,pH=7的是________,pH>7的是_______________________,pH<7的是________.
五种溶液中,pH=7的是________,pH>7的是_______________________,pH<7的是________.
6.在![]() 溶液中,
溶液中,![]() 与
与![]() 的关系是_____________,用离子反应方程式说明理由_______________________;为了使溶液中尽可能达到
的关系是_____________,用离子反应方程式说明理由_______________________;为了使溶液中尽可能达到![]() 应向溶液中加入的物质是________,用离子方程式说明理由_______________________.
应向溶液中加入的物质是________,用离子方程式说明理由_______________________.
三、计算题
1.在一定条件下,将![]() 和
和![]() 放入1升密闭容器中,反应达平衡后测得
放入1升密闭容器中,反应达平衡后测得![]() 为0.5 mol.
为0.5 mol.
求:(1)平衡时氮气的浓度.
(2)平衡时氢气的转化率.
(3)反应前与平衡后容器内压强之比.
2.在密闭容器内,已知![]() 和
和![]() 浓度分别是2 mol/L和1.2 mol/L,在一定条件下使之发生反应.
浓度分别是2 mol/L和1.2 mol/L,在一定条件下使之发生反应.![]()
![]()
![]() .2 min末测知
.2 min末测知![]() 的浓度为1.7 mol/L,则用
的浓度为1.7 mol/L,则用![]() 浓度变化表示的该反应的反应速率是多少?(2)求
浓度变化表示的该反应的反应速率是多少?(2)求![]() 的转化率.
的转化率.
3.在一定温度下,10升容器中加入![]() 和
和![]() ,反应达平衡时,有
,反应达平衡时,有![]() 发生了反应.
发生了反应.
(1)生成了________![]()
(2)平衡时,容器内总物质的量为________mol
(3)平衡时,![]() 的浓度为________mol/L
的浓度为________mol/L
(4)若反应前容器内的压强是![]() ,则平衡时容器内压强为________Pa
,则平衡时容器内压强为________Pa
计算过程:
参考答案
一、选择题(45分,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | A | BC | D | A | C | C | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| B | A | AB | A | D | D | D |
二、填空题(4,5,6,8,5,6)34分
1.+4 +1 -3 -3,+5 +3 +4 +5
2.![]()
![]()
![]()
![]()
3.2 16 2 2 5 8
![]() HCl
HCl ![]()
4.(1)增大 体积缩小方向(正反应方向)移,其他条件不变时,加大压强,平衡向体积缩小的方向进行
(2)增大 平衡向体积缩小的方向移动,向浓度降低的方向移动.
(3)逆反应方向移动,升温化学平衡向吸热方向移动.
5.![]()
![]()
![]()
![]()
![]()
6.![]()
![]()
![]()
![]()
![]()
![]()
![]()
KOH ![]()
![]()
![]() 因
因![]() 增多而抑制水解(电离平衡向左进行)
增多而抑制水解(电离平衡向左进行)
三、计算题(21分)
1. ![]()
![]()
![]()
[起] 3 3 0
[平] 2.75 2.25 0.5
[减增] 0.25 0.75 0.5
(1)平衡时![]() 浓度为2.75 mol/L
浓度为2.75 mol/L
(2)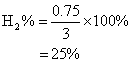
(3)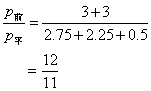
答:略
2. ![]()
![]()
![]()
[起] 2 1.2 0 ![]()
[2 min] 1.7 1.05 0.3 ![]()
[减增] 0.3 0.15 0.3 ![]()
答:略
3. ![]()
![]()
![]()
[起] 1 1 0
[平] 0.8 0.4 0.4
[减增] 0.2 0.6 0.4
(1)![]()
(2)![]()
(3)![]()
(4)![]()
![]()