高二化学九月月考试题
一、选择题
1.决定化学反应速率的主要因素是 ( )
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
2.在2A+B
![]() 3C+4D反应中,表示该反应速率最快的是
( )
3C+4D反应中,表示该反应速率最快的是
( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
3.20℃时,将0.1 mol·L-1Na2S2O3溶液10 mL和0.01 mol·L-1 H2SO4溶液10 mL混合,2 min后溶液中明显出现浑浊,已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要看到同样的浑浊,需要的时间是 ( )
A.40 s B.15 s C.48 s D.20 s
4.某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体
Z,经过t min后,测得物质的浓度分别为:
c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,
则该反应的反应式可表示为: ( )
A.X2+2Y2 ![]() 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2 ![]() X2Y
X2Y
C.3X2+Y2 ![]() 2X3Y D.X2+3Y2
2X3Y D.X2+3Y2 ![]() 2XY
2XY
5.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可
采取的措施是①再加入30毫升3摩/升盐酸 ②改用30毫升6摩/升盐酸
③改用3克粉末状大理石 ④适当升高温度 ( )
A.①②④ B.②③④ C.①③④ D. ①②③
6.可逆反应达到平衡的重要特征是 ( )
A.反应停止了 B.正逆反应的速率均为零
C.正逆反应都还在继续进行 D.正逆反应的速率相等
7.在一定条件下,反应A2(g)+B2(g) ![]() 2AB(g)达到平衡状态的标志
2AB(g)达到平衡状态的标志
是 ( )
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
8.把HI气体充入密闭容器中,在一定条件下发生反应.
2HI(g)
![]() H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说
法正确的是 ( )
A.HI的生成速率等于其分解速率
B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率
D.无法判断HI的生成速率和分解速率的相对大小
9.压强变化不会使下列化学反应的平衡发生移动的是 ( )
A.H2(气)+I2(气) ![]() 2HI(气) B. 3H2(气)+N2(气)
2HI(气) B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C.2SO2(气)+O2(气) ![]() 2SO3(气) D. C(固)+CO2(气)
2SO3(气) D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
10.在容积相同的A、B两个密闭容器中,分别充入2 mol SO2和1 mol O2,使它们在相同
温度下发生反应.2SO2+O2 ![]() 2SO3,并达到平衡,在反应过程中,若A容器保持
2SO3,并达到平衡,在反应过程中,若A容器保持
体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2
的转化率应是 ( )
A.25% B.﹥25% C.﹤25% D.12.5%
11.同温同压下,当反应物分解了8%时,总体积也增加8%的是 ( )
A.2NH3(g) ![]() N2(g)+3H2(g) B.2NO(g)
N2(g)+3H2(g) B.2NO(g) ![]() N2(g)+O2(g)
N2(g)+O2(g)
C.2NO3(g) ![]() 4NO2(g)+O2(g) D.2NO2(g)
4NO2(g)+O2(g) D.2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
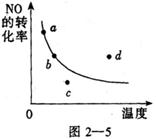 12.图2—5中的曲线是表示其他条件一定时,
12.图2—5中的曲线是表示其他条件一定时,
2NO+O2 ![]() 2NO2 放出热量。反应中NO的转化率与
2NO2 放出热量。反应中NO的转化率与
温度的关系曲线,图中标有a、b、c、d四点,其中表示
未达到平衡状态,且v(正)>v(逆)的点是 ( )
A.a点 B.b点 C.c点 D.d点
13.已经建立化学平衡的某可逆反应,当改变条件使平衡向
正反应方向移动时,下列有关叙述中正确的是 ( )
A.生成物的质量分数一定增加 B.生成物的物质的量 一定增加
C.反应物的转化率一定增加 D.反应物的浓度一定降低
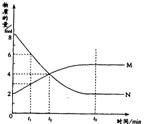 14.在一定温度下,容器内某一反应中M、N的物
14.在一定温度下,容器内某一反应中M、N的物
质的量随反应时间变化的曲线如图,下列表述中正确
的是 ( )
A.反应的化学方程式为.2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
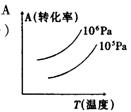 15.有一化学平衡mA(g)+nB(g)
15.有一化学平衡mA(g)+nB(g)
![]() PC(g)+qD(g),右图表示的
PC(g)+qD(g),右图表示的
转化率与压强、温度的关系。由此得出的正确结论是(
A.正反应是吸热反应,(m+n)>(p+q)
B.正反应是吸热反应,(m+n)<(p+q)
C.正反应是放热反应,(m+n)>(p+q)
D.正反应是放热反应,(m+n)<(p+q)
16.可逆反应.3A(气)==3B(?)+C(?) 吸收热量,随着温度升高,气体平均相对分子质
量有变小趋势,则下列判断正确的是 ( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
一、选择题 (本题包括16小题,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
| |||||||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
二 填空题
17. 对于反应:2SO2+O2 ![]() 2SO3,当其他条件不变时,只改变一个反应条
2SO3,当其他条件不变时,只改变一个反应条
件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编 号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 使用V2O5作催化剂 | |
| ⑤ | 压缩体积 |
18.某温度时,在2 L容器中,X、Y、Z三种物质的物质的
 量随时间变化曲线图2—3所示。由图中数据分析,该反应的
量随时间变化曲线图2—3所示。由图中数据分析,该反应的
化学方程式为:
_________________________________________________。
反应开始至2 min,Z的平均反应速率为__________。
19.化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下 列平衡.
NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度 __________,
NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有
___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
20.在某固定容积的密闭容器中,存在下列化学平衡.
aA(g)
![]() bB(g)+cC(g),在温度不变的条件下,向容器中再充入
bB(g)+cC(g),在温度不变的条件下,向容器中再充入
一定量的A物质,重新达到平衡时,判断在下列情况下有关物质量的变化趋势
(在下列空白中填写“增大”“减小”或“不变”)
(1)当a=b+c时,B的物质的量分数___________。
(2)当a>b+c时,A的物质的量分数___________。
21.在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O ![]() 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________色,因为__________。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈___________色,
因为__________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡___________,
溶液颜色将__________。
22.在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通。容器中发生以下反应:N2+3H22NH3+Q,若达到平衡后,测得混合气体的体积为7体积。据此回答以下问题:
(1)保持上述反应的温度不变,假设a,b,c分别代表初始加入的N2,H2和NH3的体积,如果反应达到平衡时,各物质的百分含量与上述平衡完全相同,那么:
①若a=1,c=2,则b=_____,在此情况下,反应开始时将向______方向进行;
②若需规定起始时,反应向逆方向进行,则C的体积范围是________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是________。
三 计算题
23.一定温度下,向密闭容器中冲入NO2,发生反应:2NO2 ![]() 2NO+O2,经过一定时间后, 测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,
2NO+O2,经过一定时间后, 测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,
求:(1)NO2的起始浓度?
(2)此时NO2的分解率?