高中同步测控优化训练(二)
第五章 烃(B卷)
说明:本试卷分为第Ⅰ、Ⅱ卷两部分,请将第Ⅰ卷选择题的答案填入答题括号内,第Ⅱ卷可在各题后直接作答。共100分,时间90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Ca 40
第Ⅰ卷(选择题 共46分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.近年来科学家利用合成的方法制备了多种与苯组成相同、具有特殊结构的物质,例如盆烯和棱晶烷。
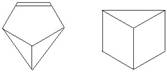
盆烯 棱晶烷
对两种物质论述正确的是
A.均为不饱和烃 B.互为同分异构体
C.均属于芳香烃 D.均为高分子化合物
解析:由结构不同、分子式为C6H6可知应选B。
答案:B
2.甲基自由基带有的电荷数为
A.-3 B.0
C.+1 D.+3
解析:自由基中含9个质子,9个电子,带电荷为0。
答案:B
3.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子进行结构分析的质谱法。其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H![]() 、C2H
、C2H![]() 、C2H
、C2H![]() ……,然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比图如图2-1所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
……,然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比图如图2-1所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
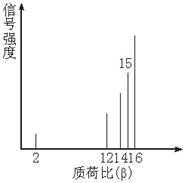
A.甲醇 B.甲烷
C.丙烷 D.乙烯
解析:这是一道信息给予题,重要的是理解质荷比的含义。质量比β为16,即该离子的相对分子质量为16,只有CH![]() ,则该有机物为CH4。
,则该有机物为CH4。
答案:B
4.能够经过催化加氢得到2—甲基戊烷的烯烃有
A.2种 B.3种
C.4种 D.5种
解析:2—甲基戊烷的结构式为
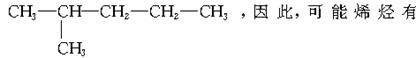


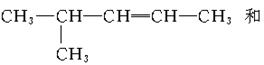
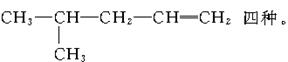
答案:C
5.有机化学反应多数是速率较慢、较复杂、副产物多,请分析下列反应的生成物为纯净物的是
A.CH4和Cl2光照 B.氯乙烯加聚
C.乙醇和浓H2SO4共热 D.乙烯与氯化氢加成
解析:烷烃的光卤代反应副产物较多,高聚物一般是混合物,乙醇和浓H2SO4作用时,温度不同,产物不同。
答案:D
6.下列物质的沸点的排列顺序正确的是
①丁烷 ②2-甲基丙烷 ③正戊烷 ④2—甲基丁烷 ⑤2,2—二甲基丙烷等物质的沸点的排列顺序正确的是
A.①>②>③>④>⑤
B.⑤>④>③>②>①
C.③>④>⑤>①>②
D.②>①>⑤>④>③
解析:烷烃同系物的沸点规律是:碳原子数越多沸点越高,同分异构体的沸点规律是:支链越少,沸点越高。
答案:C
7.乙烯中混有SO2气体,欲除去SO2得到纯净乙烯,最好依次通过下列哪组试剂的试剂瓶
A.KMnO4(H+)、浓H2SO4
B.溴水、浓H2SO4
C.NaOH溶液、浓H2SO4
D.浓H2SO4、KMnO4(H+)
解析:KMnO4(H+)和溴水既能氧化SO2,又能与乙烯发生氧化和加成反应。
答案:C
8.等物质的量的乙烯、乙烷、乙炔完全燃烧消耗的氧气的物质的量之比为
A.6∶7∶5 B.1∶1∶1
C.35∶30∶42 D.4∶5∶3
解析:烃完全燃烧的化学方程式:
![]()
将乙烷、乙烯、乙炔三者的碳氢数值代入,即可得消耗氧气的物质的量。
答案:A
二、选择题(每小题有一至两个选项符合题意,每小题3分,共30分)
9.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子化合物,请通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列产物正确的是
A.ZnC2水解生成C2H2
B.Al4C3水解生成丙炔(C3H4)
C.Mg2C3水解生成丙炔(C3H4)
D.Li2C2水解生成C2H4
解析:从CaC2和水反应生成C2H2可知,金属碳化物水解后生成的烃中氢原子总数等于金属化合价的总数。故ZnC2水解得C2H2,Al4C3水解应得C3H12(即3CH4为甲烷),Mg2C3水解得C3H4,Li2C2水解得C2H2。
答案:AC
10.下列实验能获得成功的是
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离二溴乙烷和二甲苯
解析:苯中加溴水后分层,上层为溴的苯溶液(红棕色),下层为无色水层,乙醇中加溴水不分层,苯乙烯中加溴水结果溴水褪色,且所得混合物是分层的,所以A项能成功。B项中苯仍溶解溴与反应生成的二溴己烷及过量的溴。C项中不能用溴水。D项中二甲苯能溶解二溴乙烷。
答案:A
11.(2004年·广西)0.1 mol 由两种气态烃组成的混合气体完全燃烧后,得到0.16 mol CO2和3.6 g水。混合气体中
A.一定有甲烷
B.一定是甲烷和乙烯
C.一定没有乙烷
D.一定有乙炔
解析:依题意,混合烃的平均分子组成为C1.6H4,故混合气体中一定有CH4,由于平均氢原子数为4,因而另一烃的氢原子数为4。
答案:AC
12.已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为2CH3CH2Br+2Na![]() CH3CH2CH2CH3+2NaBr,根据这一反应原理,下列所给化合物可以与钠作用合成环丁烷的是
CH3CH2CH2CH3+2NaBr,根据这一反应原理,下列所给化合物可以与钠作用合成环丁烷的是
A.CH3CH2Br B.CH3CH2CH2CH2Br
C.CH2Br—CH2Br D.CH2BrCH2CH2CH2Br
解析:根据题意信息,要得到环丁烷,卤代烃分子中要含有4个碳原子,且1号、4号碳原子上含有卤素原子,D项符合;但C选项分子在Na作用下,首尾作用也可合成环丁烷。
答案:CD
13.某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性(利用给固定装置微热的方法)。
正确的操作顺序是
A.②①③⑤④ B.②③①⑤④
C.①②③④⑤ D.⑤④③②①
解析:实验时应遵循先连接装置,后检查气密性,再加入药品的原则。
答案:B
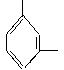
14.已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下图
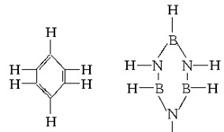
则硼氮苯的四氯取代物的同分异构体的数目为
A.2 B.3
C.4 D.5
解析:由苯环上二氯取代物和四氯取代物同分异构体数目相同(因氢、氯对换,其排列组合相同),可分析其二氯取代物的同分异构体,又因硼氮苯间位有两种情况,因此,同分异构体数目为4种。
答案:C
15.某气态烃10 mL与50 mL O2在一定条件下作用,刚好耗尽反应物,生成水蒸气40 mL,CO和CO2各20 mL(各体积均在同温同压下测得)。该烃的分子式为
A.C3H8 B.C4H6
C.C3H6 D.C4H8
解析:根据原子守恒可知10 mL烃得到CO、CO2共40 mL,则该气态烃含4个碳原子,10 mL烃燃烧得40 mL 水蒸气,可知烃分子含8个氢原子。
答案:D
16.化学工作者把烷烃、烯烃、环烷烃、炔烃……的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大方便。设键数为I,则烷烃中碳原子数跟键数的关系通式为:CnI3n+1,烯烃(视双键为两条单键),环烷烃中碳原子数跟键数关系的通式为CnI3n,则苯的同系物中碳原子数跟键数关系的通式为
A.CnI3n-1 B.CnI3n-2
C.CnI3n-3 D.CnI3n-4
解析:由题意可知每多一个双键(或环),键数比相应烷烃少1,苯的同系物相当有3个双键和一个环。
答案:C
17.气态链烃A和B的分子式分别表示为CnH2n+2和CnH2n-2,在一定条件下,200 mL A和B的混合气体与同条件下100 mL氢气恰好反应,则混合气体中,A与B物质的量之比为
A.1∶1 B.3∶1
C.3∶2 D.1∶3
解析:分析A、B分子式,可知A与H2不反应,B与H2的加成反应为:
CnH2n-2+2H2![]() CnH2n+2
CnH2n+2
1 2
50 mL 100 mL
得B为50 mL,推出A为150 mL。
答案:B
18.由CO、CH4、C2H6组成的混合气体8.96 L(标准状况),在足量O2中充分燃烧后,生成气体先通过足量浓H2SO4,再通过足量NaOH溶液,测知NaOH溶液增重26.4 g,则原混合气体中乙烷的物质的量为
A.小于0.1 mol
B.大于或等于0.1 mol,小于0.2 mol
C.一定等于0.2 mol
D.大于0.2 mol,小于0.3 mol
解析:1 mol CO或CH4完全燃烧,产生1 mol CO2;1 mol C2H6完全燃烧产生2 mol CO2,由差量法可求得C2H6为0.2 mol。
答案:C
第Ⅱ卷(非选择题 54分)
三、填空题(共38分)
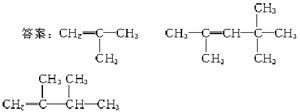
19.(6分)在一定条件下,某些不饱和烃分子可以进行自身加成反应,例如:![]() 有机物甲为:
有机物甲为:
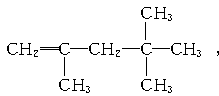
它是由不饱和烃乙的两个分子在一定条件下得到
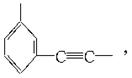
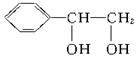
的,在此加成反应中,除生成甲外,还同时得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体,乙的结构简式为_______;丙的结构简式为_______。当两分子丙烯发生自身加成时生成最长碳链为4个碳原子的烃丁,则丁的结构简式为_______。
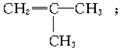 解析:由甲中碳原子数可知乙为4个碳原子,再由结构可知,乙应为
解析:由甲中碳原子数可知乙为4个碳原子,再由结构可知,乙应为
分析丙时要注意最长碳链为5个碳原子。
20.(2003年·上海)(6分)自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔![]() 为基本原料,经反应得到一系列的芳炔类大环化合物,其结构为
为基本原料,经反应得到一系列的芳炔类大环化合物,其结构为
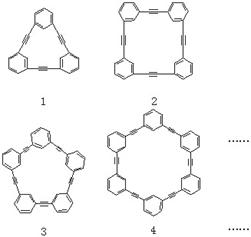
(1)上述系列中第1种物质的分子式为_______。
(2)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为_______。
(3)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯
起始物质,通过加成、消去反应制得。写出由苯乙烯制
取苯乙炔的化学方程式(所需的无机试剂自选):_______。
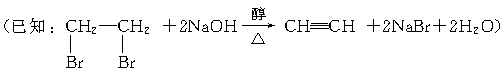
解析:(1)由第1种物质的结构知,分子中含有3个 和 —C≡C—结构,
因此分子中含碳原子数为3×6+3×2=24个,氢原子数为4×3+3×0=12个,故分子式为C24H12。
(2)由所给系列芳炔类大环化合物的结构可知,它们的结构中皆含有(n+2)个苯乙
 |
炔结构 分别应由(n+2)个苯乙炔分子形成,消耗苯乙炔与所得芳
炔类大环化合物的质量比为102×(n+2)∶100×(n+2)=51∶50。
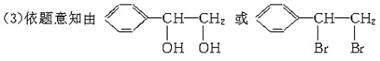
 皆可发生消去反应得到苯乙炔,但
不能由苯乙烯加成得到。故
皆可发生消去反应得到苯乙炔,但
不能由苯乙烯加成得到。故
由苯乙烯制备苯乙炔的化学方程式为:

21.(14分)(2002年·上海)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色的浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须除去之,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验_______(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是_______。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(2)乙同学推测此乙炔中必定含有一种杂质气体是_______,它与溴水反应的化学方程式是_______;在验证过程中必须全部除去。
(3)请你选用图2-2所列四个装置(可重复使用)试验乙同学的实验方案,将它们的编号填入方框,并在括号中写出装置内所放的化学药品。
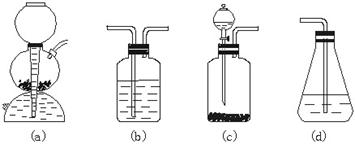
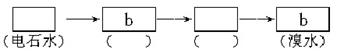
图2-2
(4)为验证这一反应是加成而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是_______。
解析:由实验室制乙炔的原料和反应,可知反应中一般有H2S气体杂质。又知乙炔的典型性质为加成反应,可知通入溴水后,溴水中不会有HBr生成。
答案:(1)不能 a c
(2)H2S Br2+H2S===S↓+2HBr
(3)c b CuSO4溶液 CuSO4溶液
(4)如发生取代反应,必定生成HBr,溶液酸性将明显增强,故可用pH试纸验证
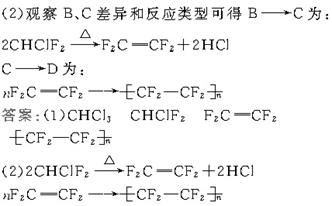
22.(12分)聚四氟乙烯的耐热性和化学稳定性都超过了其他塑料,号称“塑料王”,在工业上有广泛的用途。其合成路线如下所示:

(1)在方框中填入合适的有机物的结构简式。
(2)写出下列转化的化学方程式:B![]() C:_______;C
C:_______;C![]() D:_______。
D:_______。
解析:(1)根据合成路线中各物名称可写出A.CHCl3;B.CHClF2;C.F2C==CF2;![]()
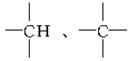 四、计算题(共16分)
四、计算题(共16分)
23.(6分)烷烃分子中的基团:—CH3、—CH2—、 中的碳
原子分别称为伯、仲、叔、季碳原子,其数目分别为n1、n2、n3、n4,则烷烃(除CH4外)中存在的关系有(用以上符号回答):
(1)烷烃分子中四种碳原子数之间的关系为n1=__________。
(2)若某烷烃分子中n2=n3=n4=1,则满足此等式的该分子的结构可能有_______种。
解析:烷烃的通式为CnH2n+2,即知C、H原子数的关系。题中烷烃碳原子总数为n1+n2+n3+n4,氢原子总数为3n1+2n2+n3,故有3n1+2n2+n3=2(n1+n2+n3+n4)+2,所以n1=n3+2n4+2。
(2)据(1)知n1=5,则分子式为C8H18。
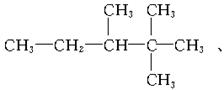
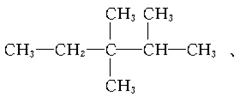
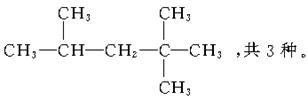
答案:(1)n3+2n4+2 (2)3
24.(2004年·江苏)(10分)石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
![]()
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率=![]() ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2==CH2+4HCl+O2![]() 2CH2Cl—CH2Cl+2H2O ③
2CH2Cl—CH2Cl+2H2O ③
由反应①③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%,试计算:
反应①③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
解析:(1)设生成的氯乙烯和氯化氢质量分别为x、y 。
由反应①②得:
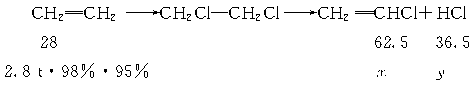
解得:氯乙烯为5.8 t,氯化氢为3.4 t。
(2)设投入反应①、③的乙烯物质的量分别为x、y,则:
由反应①生成的二氯乙烷为x·a%,
由反应③生成的二氯乙烷为y·c%。
则由反应①③共制得二氯乙烷的物质的量为(x·a%+y·c%),通过反应②可获得HCl的物质的量为(x·a%+y·c%)·b%。
据题意,反应③消耗的HCl为2·y·c%,则:
2·y·c%=(x·a%+y·c%)·b%
解得:![]()
反应①③中乙烯的投料比应为![]() 。
。
答案:![]()