重要的氧化剂和还原剂
重点、难点
1. 熟悉常见的氧化剂和还原剂。
2. 重要的氧化剂和还原剂的常见反应。
3. 熟练使用单线桥分析氧化还原反应及电子转移情况。
具体内容
(一)重要的氧化剂和还原剂
1. 氧化还原反应的基本概念
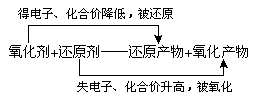
氧化还原反应从化合价的角度来说是指有元素化合价升降的化学反应;从本质上来看则是指有电子转移(得失或偏移)的反应。涉及氧化剂、还原剂、氧化性、还原性等概念。
(1)氧化剂、还原剂的概念及它们在氧化还原反应中关系,及其本质变化及外在表现。
氧化剂是指在反应中得到电子(或电子对偏向)的物质,表现为反应后所含某些元素化合价降低。氧化剂具有氧化性,在反应中本身被还原,其生成物叫还原产物。
还原剂是指在反应中失去电子(或电子对偏离)的物质,表现为反应后所含某些元素化合价升高,还原剂具有还原性,在反应中本身被氧化,其生成物是氧化产物。
(2)氧化剂和还原剂是性质相反的物质
在氧化还原反应中,还原剂把电子转移给氧化剂,即还原剂是电子的给予体,氧化性是电子的接受体。
(3)氧化还原反应中各概念间的关系

2. 氧化还原反应的判断和分析
(1)氧化还原反应的判断
判断一个化学反应是否为氧化还原反应,常根据反应中有无元素的化合价变化(有升有降)来判断。
判断一个反应是否为氧化还原反应的技巧:
① 当有单质参与反应,或有单质生成时可认为该反应一定是氧化还原反应。
② 有机物发生的反应,当分子中引入氧或失去氢可认为被氧化,反之分子中失去氧或得到氢可认为被还原。
(2)氧化还原反应的分析
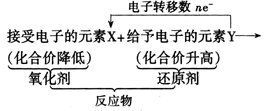
在氧化还原反应化学方程式里,除了可用箭头表明同一元素原子的电子转移情况外,还可以用箭头表示不同原子的电子转移情况。
用箭头表明同一元素原子的电子转移情况即大家熟悉的“双线桥”。如:
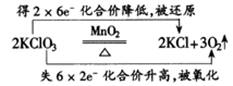
用箭头表示不同原子的电子转移情况——“单线桥”。如:
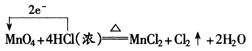
更好地体现了氧化剂和还原剂在反应中的关系。
再如:
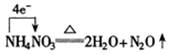
① 单线桥分析氧化还原反应可简单表示为
② 反应中电子转移总数等于还原剂给出的电子总数,也必然等于氧化剂接受的电子总数。
3. 常见的氧化剂、还原剂
(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
① 元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如![]() 、
、![]() 。
。
② 元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如![]() 和
和![]() 。
。
③ 元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如![]() 。
。
(2)重要的氧化剂
① 活泼非金属单质,如F2、Cl2、Br2、O2等。
② 元素处于高价时的氧化物、含氧酸、盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③ 过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂
① 活泼的金属单质,如Na,K,Zn,Fe等。
② 某些非金属单质,如H2,C,Si等。
③ 元素处于低化合价时的氧化物,如CO,SO2等。
④ 元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤ 元素处于低化合价时的盐,如Na2SO3,FeSO4等。
(二)重要氧化剂和还原剂的常见反应
1. 实验分析
(1)Cl2,Br2,I2氧化性的比较。
卤素单质氧化性顺序按F2,Cl2,Br2,I2的顺序逐渐减弱。
[问题讨论]当把Cl2和HBr混合会有何现象?若将碘化钾淀粉试纸置于盛Cl2的集气瓶上一定有变化吗?若想观察到期望的现象应如何操作?若熏久了又会有何现象?
[简析]Cl2可与HBr反应:Cl2+2HBr==2HCl+Br2,可看到有橙红色液滴生成,且Cl2的黄绿色变淡,干燥的碘化钾淀粉试纸与Cl2不反应,因为该反应为离子反应,需在溶液中进行;故需将试纸先用蒸馏水湿润,但熏久了,由于潮湿的Cl2还有另一重要性质——漂白性,会使变蓝的试纸又褪色。
(2)Fe,Fe2+,Fe3+间的氧化还原反应。
Fe与强氧化剂(足量)直接反应可被氧化为![]() ,而与弱氧化剂(如H+,S等)反应被氧化为
,而与弱氧化剂(如H+,S等)反应被氧化为![]() ;且
;且![]() 可被强氧化剂(如Cl2,Br2,HNO3、
可被强氧化剂(如Cl2,Br2,HNO3、![]() )等氧化为
)等氧化为![]() 。
。
[问题讨论]
① Fe与浓硫酸反应一定只能得到Fe2(SO4)3吗?
② FeSO4溶液中加溴水可氧化Fe2+为Fe3+,改用氯水、碘水行吗?
③ 铁盐(Fe3+)如何转化为亚铁盐(Fe2+)?向FeCl3溶液中加Cu粉行吗?通入SO2行吗?
④ FeCl3溶液可与KSCN溶液反应而使溶液呈血红色,还有什么溶液也可与FeCl3溶液反应而发生颜色变化?
答:
① 铁过量时得FeSO4。
② 氯水可代替溴水,碘水不行,因:2Fe3++2I-==2Fe2++I2。
③ 加入还原剂可还原Fe3+,Cu粉和SO2均能还原Fe3+得到Fe2+。
④ 苯酚溶液中加入FeCl3溶液呈紫色。
2. 氧化剂、还原剂之间反应规律
(1)对于氧化剂来说,同族元素的非金属原子,它们的最外层电子数相同而电子层数不同时,电子层数越多,原子半径越大,就越难得电子。因此,它们单质的氧化性就越弱。
(2)金属单质的还原性强弱一般与金属活动顺序相一致。
(3)元素处于高价的物质具有氧化性,在一定条件下可与还原剂反应,在生成的新物质中该元素的化合价降低。
(4)元素处于低价的物质具有还原性,在一定条件下可与氧化剂反应,在生成的新物质中该元素的化合价升高。
(5)稀硫酸与活泼金属单质反应时,是氧化剂,起氧化作用的是![]() ,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是
,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是![]() ,被还原后一般生成SO2。
,被还原后一般生成SO2。
(6)不论浓硝酸还是稀硝酸都是氧化性极强的强氧化剂,几乎能与所有的金属或非金属发生氧化还原反应,反应时,主要是![]() 得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
(7)变价金属元素,一般处于最高价时的氧化性最强,随着化合价降低,其氧化性减弱,还原性增强。
氧化剂与还原剂在一定条件下反应时,一般是生成相对弱的还原剂和相对弱的氧化剂,即在适宜的条件下,可用氧化性强的物质制取氧化性弱的物质,也可用还原性强的物质制取还原性弱的物质。
常见的氧化性、还原剂及其还原产物、氧化产物,填写下表
| 氧化剂 | 还原产物 | 还原剂 | 氧化产物 |
| O2 | 活泼金属 | ||
| Cl2,Br2,I2 | H2 | ||
| 浓H2SO4 | C | ||
| HNO3 | Si | ||
| MnO4- | CO | ||
| Fe3+ | Fe2+ | ||
| Na2O2,H2O2 | SO2,SO32- |
答案:
| 氧化剂 | 还原产物 | 还原剂 | 氧化产物 |
| O2 |
| 活泼金属 | 金属离子 |
| Cl2,Br2,I2 | Cl-,Br-,I- | H2 | H2O, |
| 浓H2SO4 | SO2,S,H2S | C | CO,CO2 |
| HNO3 | NO,NO2,NH4+ | Si | SiO2,SiCl4 |
| MnO4- | Mn2+,MnO2、MnO42- | CO | CO2 |
| Fe3+ | Fe2+,Fe | Fe2+ | Fe3+ |
| Na2O2,H2O2 | O2-,H2O | SO2,SO32- | SO3,SO42- |
(三)判断氧化剂或还原剂强弱的依据
1. 根据方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2. 根据反应条件判断
当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难易来进行判断,如:
4HCl(浓)+MnO2 ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑
易知氧化性:KMnO4>MnO2。
3. 由氧化产物的价态高价来判断
当含变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物相关元素价态的高低来判断氧化剂氧化性的强弱。如:
2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
Fe+S ![]() FeS
FeS
可知氧化性:Cl2>S。
4. 根据元素周期表判断
(1)同主族元素(从上到下):非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强;金属原子(或单质)还原性逐渐增强,对应阳离子氧化性逐渐减弱。
(2)同周期元素(从左到右):原子或单质还原性逐渐减弱,氧化性逐渐增强。阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。
【典型例题】
1. 氧化还原反应中电子转移的方向和数目
[例1] 标出反应11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4的电子转移方向和数目,该反应中氧化剂有_______,还原剂为_______,1mol CuSO4中能氧化P原子的物质的量是________。
答案:
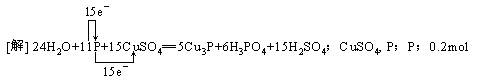
解析:可以先标出有变价的元素的化合价,发现P元素的化合价有升有降,则其既作了氧化剂又作了还原剂,CuSO4中的Cu元素化合价降低,故CuSO4也是氧化剂,因为1mol CuSO4在反应中只有Cu能获得1mol e-,而1mol P被氧化会能出5mol e-,故1mol CuSO4反应氧化0.2mol P。
2. 氧化剂、还原剂的确定
[例2] 氢阴离子(H-)能和NH3反应:H-+NH3==NH2- +H2↑。根据上述反应事实可以得到的正确结论是( )
A. NH3具有还原性 B. H-是很强的还原剂
C. 该反应的还原产物是H2 D. 该反应属于置换反应
答案:B
解析:液氨中NH3分子能发生如下的电离NH3=![]() +H+,H-与NH3分子的反应实质上就是H-和NH3分子电离出来的H+发生反应生成H2,由于H-失电子能力强,所以H-是很强的还原剂。NH3分子中的H得到电子,它是氧化剂。H2是H-失电子的氧化产物,也是H+得电子的还原产物,因此H2既是氧化产物又是还原产物。由于该反应中无单质参加,该反应不符合置换反应的定义。
+H+,H-与NH3分子的反应实质上就是H-和NH3分子电离出来的H+发生反应生成H2,由于H-失电子能力强,所以H-是很强的还原剂。NH3分子中的H得到电子,它是氧化剂。H2是H-失电子的氧化产物,也是H+得电子的还原产物,因此H2既是氧化产物又是还原产物。由于该反应中无单质参加,该反应不符合置换反应的定义。
3. 判断氧化剂、还原剂的相对强弱
[例3] 根据下列反应,判断M、N、P、Q的还原性由强到弱的顺序是( )
① NCl2+P=N+PCl2 ② 2MCl3+3N=2M+3NCl2 ③3QCl2+2M=2MCl3+3Q
A. M>N>P>Q B. P>N>M>Q C. Q>P>N>M D. N>M>P>Q
答案:B
解析:根据氧化还原剂反应的规律可知,当一个氧化还原反应按正反应方向进行时,一般情况下,氧化性是:氧化剂>氧化产物;还原性是:还原剂>还原产物。对于反应①,还原剂是P,还原产物N,因此还原性是P>N;对于反应②,还原剂是N,还原产物是M,还原性是N>M,以此类推反应③中还原性M>Q。根据以上关系可得:还原性是P>N>M>Q。
[例4] 现有下列三个氧化还原反应存在:
① 2FeCl3+2KI=2FeCl2+2KCl+I2;
② 2FeCl2+Cl2=2FeCl3;
③ 2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑。
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。下列试剂中,可加入的试剂是( )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
答案:C
解析:可由三个反应方程式得出如下结论:氧化性:MnO4- >Cl2>Fe3+>I2;还原性:Mn2+<Cl-<Fe2+<I-。所以MnO4- 可氧化Cl-、Fe2+、I-,Cl2能氧化Fe2+、I-,只有Fe3+只能氧化I-,因而符合题意的氧化剂只能为C。
4. 氧化还原反应的分析
[例5] 在新生代的海水里有一种铁细菌,它们摄取海水中的Fe2+,把它转变为它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿,这个用酶为催化剂的反应的另一反应物是CO2,它在反应后转变成有机物(用甲醛表示),写出该反应的离子方程式并标出电子转移的方向和数目。
答案:
![]()
解析:题意可得,该反应的反应物有Fe2+、CO2等,氧化产物为Fe2O3,还原产物为HCHO,有无其他反应物或生成物呢?我们可以先初步写出一个不完整的方程式:Fe2++CO2——Fe2O3+HCHO,不难看出,由原子守恒可知缺少含H的反应物,那是H+呢还是H2O呢?根据新生代海水中不可能有强酸存在,猜测H2O更合理,于是将上反应进一步写成:Fe2++CO2+H2O——Fe2O3+HCHO,然后进行配平,根据氧化还原方程式配平的一般步骤:① 先考虑电子守恒,配平发生氧化还原反应的氧化剂、还原剂的化学计量数为:4Fe2++1CO2+H2O——2Fe2O3+1HCHO;② 再考虑电荷守恒,使左右两边净电荷相等,易知右边尚缺阳离子,显然为H+。③ 最后考虑原子守恒以观察法配平修正所有物质的化学计量数。
5. 有关氧化还原反应的计算
[例6] 在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑反应中,若有5mol水作还原剂时,则由水还原的BrF3的物质的量为多少?
答案:见解析
解析:对于本题的回答,很多同学会稍加思索后回答为3 mol,该答案是错误的。因为仔细分析本反应就可发现反应物BrF3既作氧化剂,又作还原剂,而H2O只有一部分作还原剂,还有一部分仅作反应物而没有发生化合价的变化。在该反应中3mol BrF3,其中1 mol作还原剂,2 mol作氧化剂,5 mol H2O中只有2 mol H2O作还原剂,也就是在反应中是2 mol H2O、1 mol BrF3共同还原2mol BrF3。因此要回答5 mol H2O还原多少BrF3可从得失电子数目来计算。5 mol H2O共失去电子2e-×5 mol=10 mol e-,而1 mol ![]() →
→![]() 得电子3e-×1 mol=3 mol e-,根据电子守恒则由水还原的BrF3的物质的量为
得电子3e-×1 mol=3 mol e-,根据电子守恒则由水还原的BrF3的物质的量为![]() mol。
mol。
a. 判断反应是否属于氧化还原反应,并判断氧化剂、还原剂、氧化产物、还原产物,配平氧化还原反应的方程式,计算电子转移的数目,比较氧化剂的氧化性或还原剂的还原性的强弱,这些常规考点的题型以选择题和填空题为主。
[例7](2002·上海)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg·L-1,现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O,被氧化的元素是_______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:____KOCN+___KOH+___Cl2→____CO2+____N2+____KCl+____H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯_____g。
答案:(1)碳 (2)2,4,3,2,1,6,2 (3)35.5
解析:
(1)在反应KCN+2KOH+Cl2→____KOCN+2KCl+H2O中,碳元素的化合价从+2价上升到+4,失电子,被氧化。
![]() (2)从KOCN+KOH+Cl2→CO2+N2+KCl+H2O可知,N元素的化合价从-3升至0,而Cl元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得:
(2)从KOCN+KOH+Cl2→CO2+N2+KCl+H2O可知,N元素的化合价从-3升至0,而Cl元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得:
![]()
2KOCN+4KOH+3Cl2→2CO2+N2+2H2O+6KCl。
(3)从KCN+2KOH+Cl2→KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2→2CO2+N2+6KCl+2H2O可知2KCN+8KOH+5Cl2→2CO2+N2+10KCl+4H2O即2KCN→5Cl2。
处理上述20L废水,使得KCN完全转化为无毒物质、至少需液氯质量为![]() =35.5g
=35.5g
b. 依据质量守恒、电子守恒、电荷守恒等解决一些计算型问题
[例8](2000·全国)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现在NO与NH3的混合物1 mol,充分反应后得产物中经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
答案:
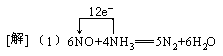
(2)0.3mol NO和0.7mol NH3或0.2mol NH3和0.8mol NO
解析:
(1)略。
(2)6 mol NO还原得到3 mol N2,4 mol NH3氧化得到2 mol N2,两者相差1 mol N2,现相差N2 1.4g,即0.05mol,相当于0.3mol NO和0.2NH3反应。依题意NO和NH3的总质量的量为1 mol, 其中必有一种为过量,所以有两种情况:0.3mol NO和0.7mol NH3;0.2mol NH3和0.8mol NO。
【模拟试题】
1. 下列说法中,正确的是( )
A. 氧化剂具有氧化性
B. 氧化剂发生氧化反应
C. 氧化剂发生反应后生成氧化产物
D. 氧化还原反应的任何一种反应物不是氧化剂就必定是还原剂
2. 盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是( )
A. 氧化性 B. 还原性 C. 酸性 D. 金属性
3. 下列说法中完全正确的是( )
A. 失电子难的原子,其获得电子的能力一定强
B. 在反应中,金属单质只表现还原性,非金属单质只表现氧化性
C. L层比M层多一个电子的元素,其单质一定具有较强的氧化性
D. 有单质参加的化学反应不一定都是氧化还原反应
4. 下列各组物质中,通常作氧化剂的是( )
A. SO2、H2O、N2 B. HNO3、F2、KMnO4
C. CO、Br2、CO2 D. HNO3、FeSO4、NaClO
5. 下列叙述中,正确的是( )
A. 含金属元素的离子不一定是阳离子
B. 在氧化—还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变化游离态时,该元素一定被还原
D. 金属阳离子被还原一定得到金属单质
6. 下列各组中的离子因发生氧化还原反应而不能大量共存的是( )
A. H+、Na+、SO32-、Cl- B. Ca2+、K+、S2-、CO32-
C. Fe2+、H+、Cl-、NO3- D. HCO3-、Br-、OH-、SO42-
7. 根据下列三个反应的化学方程式,下列关系式正确的是( )
① I2+SO2+2H2O=H2SO4+2HI
② 2FeCl3+2HI=2FeCl2+2HCl+I2
③ 2FeCl2+Cl2=2FeCl3
A. 氧化性:Fe3+>Cl2>H2SO4>I2 B. 还原性:SO2>I- Fe2+>Cl-
C. 2Fe+3I2 水2FeI3 D. FeI2+Cl2=FeCl2+I2
8. Zn+NH4NO3+2HNO3=Zn(NO3)2+N2↑+3H2O的反应中,参加反应的锌和被还原的硝酸根的物质的量之比是( )
A. 1:3 B. 1:1 C. 1:2 D. 3:1
9. 锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,则HNO3的还原产物可能是( )
A. NH4NO3 B. N2O C. NO D. NO2
10. 硫酸铵在强热条件下分解生成NH3、SO2、N2和水的反应中氧化产物和还原产物的物质的量之比是( )
A. 2:3 B. 4:3 C. 1:1 D. 1:3
11. 有X、Y、Z三种金属,把Y投入XCl2溶液中一段时间后,溶液质量增大,把Z投入YSO4溶液中一段时间后,溶液的质量减小,则这三种金属的还原性由强到弱的顺序正确的是( )
A. X>Y>Z B. Y>X>Z C. Z>Y>X D. Z>X>Y
12. 为消除碘缺乏病,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可和I-发生反应:IO3-+ 5I-+ 6H+=3I2 + 3H2O根据此反应,可用试纸和日常生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:① 自来水,② 蓝色石蕊试纸,③ 碘化钾淀粉试纸,④ 淀粉,⑤ 食糖,⑥ 食醋,⑦ 白酒。进行上述实验时必须使用的物质是( )
A. ①③ B. ③⑥ C. ②④⑥ D. ①②④⑤⑦
13. 24mL浓度为0.05mol/LNa2SO3溶液,恰好与20mL浓度为0.02mol/LK2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A. +6 B. +3 C. +2 D. 0
14. 氯气通入含有下列离子的溶液中不会与下列反应的离子是( )
A. OH- B. S2- C. SO32- D. H+
15. 制备氰氨基化钙的化学方程式 CaCO3 + 2HCN=CaCN2 +CO+H2 +CO2 在反应中( )
A. 氢元素被氧化,碳元素被还原 B. HCN既是氧化剂,又是还原剂
C. CaCN2是氧化产物,H2是还原产物 D. CO为氧化产物,H2为还原产物
16. 酸化的KMnO4溶液中加入H2O2,MnO4-被还原成Mn2+,并有O2放出,写出反应的离子方程式_______。
17. 在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,氧化剂是______,还原剂是_____,被氧化的元素是_________。被还原的元素是_________,氧化产物_______,还原产物__________。
18. NaBH4是一种强还原剂
(1)NaBH4极易溶于水,并与水剧烈反应放出H2,反应后硼以![]() 存在,写出反应的离子方程式_______。实验表明溶液酸性越强,生成H2的速度越快,其原因是______。
存在,写出反应的离子方程式_______。实验表明溶液酸性越强,生成H2的速度越快,其原因是______。
(2)在碱性条件下,NaBH4不是与水反应,而可使许多金属离子还原为原子,硼仍以![]() 存在。例如冶金工业中,用NaBH4可使Au3+的废液中的Au3+还原,其离子反应方程式是________。
存在。例如冶金工业中,用NaBH4可使Au3+的废液中的Au3+还原,其离子反应方程式是________。
(3)在20世纪60年代,德国的拜尔药厂用下面的反应把NaBH4的生产发展成工业规模:Na2B4O7+Na+H2+SiO2→NaBH4+Na2SiO3试配平上述化学反应方程式。
19. 配平下列氧化还原反应,指出氧化剂,还原剂,氧化产物,还原产物,标出电子转移的方向和数目
(1) CuSO4 + KI —— CuI↓ + I2 +
(2) NO2 + H2O —— HNO3 + NO
20. 高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4 + HBr ® Br2 + MnBr2 + KBr + H2O
其中还原剂是 。若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是 mol。
21. 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
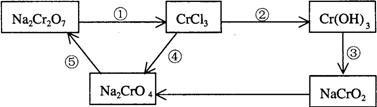
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
![]() Na2Cr2O7 + KI+
HCl —— CrCl3 + NaCl +
KCl+ I2+
Na2Cr2O7 + KI+
HCl —— CrCl3 + NaCl +
KCl+ I2+
22. 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
![]()
![]() KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O
KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O
23. 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
【试题答案】
1. A 2. A 3. CD 4. B 5. A
6. C 7. B 8. B 9. AB 10. D
11. C 12. B 13. B 14. D 15. BC
16. 2MnO4-+5H2O2+6H+====2Mn2++8H2O+5O2↑
17. KClO3;HCl;Cl;Cl;Cl2;Cl2
18.
(1)BH4-+2H2O====4H2↑+BO2-;BH4-中H显负价,c(H+)大有利于H+与-1价氢发生反应生成H2
(2)![]()
(3)![]()
19.
(1) 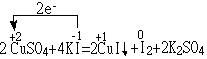
CuSO4是氧化剂,KI是还原剂,CuI是还原产物,I2是氧化产物
(2)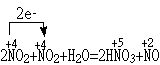
NO2氧化剂,NO2是还原剂,NO是还原产物, HNO3是氧化产物
20. HBr 0.5
21.
(1)①,④
(2)![]()
(3)
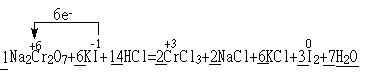
22.
(1)碳(或C)
(2)![]()
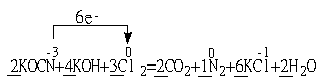
(3)35.5
23.
(1)2MnSO4+5K2S2O8+8H2O![]() 2KMnO4+4K2SO4+8H2SO4
2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4
(3)2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(4)Cl2(答HClO或HClO3也给分)