高二化学(人教版)会考复习资料(高二全年内容)
![]() 班级____________ 姓名_____________
班级____________ 姓名_____________ ![]()
第八单元 氮和氮的化合物
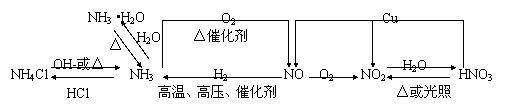
氮及其重要化合物之间的转化关系:
1、氮族元素(第____族):包括______、______、_____、______、______,随着核电荷数的递增,元素非金属性逐渐_________,金属性逐渐________,密度逐渐________,熔沸点先________,后_______。氮族元素(R)气态氢化物通式为________,最高价氧化物通式为_______,其水化物通式为_______。
2、氮及其化合物:
(1)氮气(N2)⊙分子结构:具有______键的____原子分子,化性、结构____。
⊙物性:____色_____味_____体,_____溶于水,_____法收集。
⊙化性:①与O2反应:_____________②与H2反应____________
*氮的固定:_____________________
(2)氮的氧化物⊙NO:____色____味_____体,_____毒,易与______化合结合生成______,_____法收集;
⊙NO2:____色____味_____体,_____毒,_____法收集,
能与______反应生成______,化学方程式:__________________________。
(3)氨气(NH3)⊙物性:____色____味_____体,_____溶于水, _____液化。
⊙化性:①与H2O:大部分生成__________,由于部分电离出_____离子,反应方程式______________________________,故氨水显____性,一水合氨受热易分解,化学方程式_______________________________________
②与三酸(______、_______、______),其中NH3遇____酸不会冒白烟,与HCl反应的方程式:_____________________________。
③氨的催化氧化:________________________________
(4)铵盐(例NH4Cl)①与碱反应:______________________________________
②NH3的实验室制法:用______与______共热制NH3,化学方程式为:
________________________________。在右边空白处画出此实验的装置图→
所有铵盐跟碱共热都产生刺激性气味的氨气,通用的离子方程式:
___________________,使湿润的红色石蕊变____,利用此性质可检验_______的存在。
③不稳定性(受热易分解):____________________________________
(5)硝酸(HNO3):⊙物性:______色______味______体,______挥发,工业:_____色,原因是__________________
⊙化性:不稳定性:________________________,分解放出的NO2溶于浓HNO3,使硝酸呈_____色,所以硝酸须盛在______瓶里,放在____处。
浓HNO3、纯HNO3跟___、___、__发生钝化。
浓HNO3和稀HNO3都具有_______性,都能跟Cu反应,前者反应____,有_____色_____气体产生;后者反应_____,有____色_____气体产生,遇空气后变______色。有关反应的化学方程式:①________________________
②_______________________________③_____________________________
第九单元 化学平衡 电离平衡
1、化学反应速率(化学反应的快慢) 通常用____时间内_______的_____或_______的_____来表示。
(1)表示方法(公式):______________或_______________。
(2)单位:__________、_________、________。
(3)特点: A、能否用不同物质表示同一反应速率?_____。所得数值可能不同,但含义是否相同______。
B、在同一反应中,各物质表示的同一反应的_______比=_____比=______比。
(4)、影响化学反应速率的因素
内因:_________性质是化学反应速率快慢的决定性因素,举例___________。
外因:A、浓度(C):成____比关系,但有例外(举例):______________________。
B、压强(P):成____比关系,只针对于___态体系。
C、温度(T):绝对成____比关系。
D、催化剂:只能说_____反应反应速率,有____催化剂与___催化剂之分。
E、其他:光、反应物表面积越大,反应速率_____,反应颗粒物越小,反应速率_____,若形成原电池一般会____反应速率。
2、化学平衡(反应完成程度)
(1)化学平衡的研究对象是________注意:必须强调在“_____条件下”;
(2)化学平衡建立的条件(标志):______=______
(3)化学平衡的特征(5字):____、______、______、______、_______。
(4)影响因素(化学平衡的移动及影响平衡的条件):
A、浓度:增大反应物的浓度,平衡向_____________方向移动。
B、压强:增大压强(即缩小体积),平衡向_______________方向移动。例外不移动:______________或___________。
C、温度:升高温度,平衡向_______________方向移动。
将上述3个方面归纳起来:即是_________原理(化学平衡移动原理)。那么催化剂是否会使化学平衡发生移动?______。
3、电离平衡(1)电解质(___、____电解质),判断前提条件______,单质是否是电解质?(举例)哪些是电解质______,哪些是非电解质______。电解质与电解质溶液有何区别?(2)强、弱电解质的比较表(参考P世纪金榜 )
A、电离程度:强→____电离;弱→_____电离;B、哪者是不可逆?_____;C、实例:强→___酸(HCl、HNO3、H2SO4)、___碱(KOH、NaOH、Ba(OH)2、Ca(OH)2 )、绝大多数的盐(包括_____盐,);D、弱→___酸(HF、H2S、H2SO3、H2CO3、HClO、H3PO4、CH3COOH);____碱(NH3·H2O、Cu(OH)2、Fe(OH)3 )、____性氢氧化物(______)、_____。 还有有机中学到______也有两性。
E、书写符号:强→____;弱→____。
(3)弱电解质的电离平衡A、概念:一定条件(如____、____)下,当V___=V____时,达到平衡状态。B、特征:____、_____、____。
C、影响因素:①____,升T,向_____移动,原因是电离过程是__热的过程;②_____,加水,向_____移。
4、水的电离和溶液的PH
(1)水的电离:水是属于___电解质,电离方程式________________,水中C(H+)____C(OH-),两种离子浓度的乘积是_____积表达式:KW=_________,常温(25℃),C(H+)____C(OH-)=______mol/L,KW=_______。离子积公式应用广泛,如酸性溶液中,KW=__________;如碱性溶液中,KW=________。
水的电离过程是___热的,升温则____(填促进、抑制)水的电离,则KW变__。
(2)溶液的酸碱性与PHA、溶液的酸碱性→一般原则:C(H+)=C(OH-)___性;C(H+)>C(OH-)___性,C(H+)<C(OH-)___性。→25℃,C(H+)= _____mol/L ___性,C(H+)<_____mol/L ___性,C(H+)>______mol/L ___性。
B、溶液酸碱性表示法
当C(H+)<__mol/L,常用____来表示溶液的酸碱性,公式:______________或________________。C(H+)越大,溶液酸性越____,PH越____,C(OH-)越大,溶液碱性越____,PH越____。
5、盐类水解:(1)盐的组成类别:(举例)强酸强碱盐,PH____7,如_________;强酸弱碱盐,PH____7,如_________;强碱弱酸盐,PH____7,如__________,弱酸弱碱盐,PH____7,如___________。
(2)盐类水解:(前提:_____性盐,可以看成_____反应的逆反应)
(3)水解反应的化学方程式与离子方程式(例:NH4Cl、CH3COONa、Al2(SO4)3、Na2CO3、Na2S、)注意:书写符号______,考虑分步,单双水解反应的书写格式。
(4)有___才水解,无___不水解,越___越水解,都弱____水解;谁___显谁性,同强显____性。
6、酸碱中和滴定;用_________(或___)来测定________的酸(或____)的方法。
(1)原理:H++OH-=H2O;当VA:VB=1:1,CAVA= CBVB。
(2)仪器:____式滴定管、___式滴定管、_____瓶、______夹,_____台等。
(3)关键:准备测量酸、碱溶液体积和准备判断滴定终点。(参看以前材料)
第十单元 几种重要的金属
1、镁和铝:
(1)金属通性:A、物性→_____性、____性、____性,具有____光泽等; B、(2)化性:易___电子,变成______,一般表现____性,特殊?
金属活动顺序请书写:__________________________________________
注意: ____、____、_____金属常温下能与水的反应放出____,它们与盐溶液反应,(举例)如__+FeSO4?______________________________________
(3)合金的判断方法:____________________。
铝及其重要化合物之间的转化关系:

说明:①Al、Al2O3、Al(OH)3既能与酸反应,又能与___反应。Al是_____金属,Al2O3是___性氧化物,Al(OH)3为____性氢氧化物。
②常温下,铝与浓_____、浓______发生钝化。
③实验室为更好制得Al(OH)3,宜用______与______反应,为什么?
④明矾,化学式___________,常作_____剂,其原理用离子方程式表示______________________________。
2、铁和铁的化合物
(1) Fe位于第___周期第____族,最外层____个电子,易失___个电子变成___,或失去___个电子变成___。
(2)Fe的性质 Fe颜色_____或_____。
| 与O2反应(点燃) | Fe+ O2= (____色固体) |
| 与其他非金属反应 | Fe+ Cl2= Fe+S= |
| 与水反应 | Fe+ H2O(g)= |
| 与酸反应 | (1)常温下浓_______、浓_______使铁钝化 |
| 与盐溶液反应 | Fe+ Cu2+= Fe+ Fe3+= |
(3) Fe3+离子的检验:溶液____色,方法_______________________,
离子方程式:__________________________________
3、金属冶炼→根据金属_____的不同,采用三种方法_____(___金属)、______(____金属)、______(____金属)。
4、原电池形成的判断(___个条件)。 ___极:较活泼金属,发生____反应;___极:较不活泼金属,发生____反应。
反应原理→例:铜-锌原电池 (—)Zn电解质溶液Cu(+)
负极:_____________________________,发生______反应。
正极:_____________________________,发生______反应。
电流方向:从_____极流向_____极。
第十一单元 烃
一、烃的分类(与氧气反应的通用方程式:______________________________)
| 分类 | 结构特点 | 通式 | 代表类别 | 代表物 | |
| 饱和烃 | _____烃 | 只含______键 | CH4 | ||
| 不饱和烃 | _____烃 | 含________键 | CH2=CH2 | ||
| _____烃 | 含________键 | CH≡CH | |||
| _____烃 | 含________ | 苯、甲苯、二甲苯、乙苯 | |||
二、烃的代表物各项比较
1、甲烷:分子式_______,结构简式________。
它是______的主要成分,俗名_____、______。空间结构____体,结构式_______。物性:____色____味_____,___溶于水,密度比空气_____。
化性:(1)取代(与氯气光照,要求____光,现象:_______________________),反应化学方程式1:1_____________________,不论以何种比例,产物___种;(2)氧化(与氧气,现象:____________),方程式:____________________。
(3)高温加热分解化学方程式:__________________,用途:____________。
2、乙烯:分子式_______,结构简式________。
它是_______结构,结构式:__________。物性:____色____味_____,___溶于水,密度比空气_____。
化性:(1)加成(与卤素、H2、卤化氢、水等)
A、与Br2反应:___________________B、水化法____________________。
(2)氧化:A、使______褪色;B、与O2(现象:_______)__________________。
(3)加聚:反应式________________________。
用途:___________,实验室制法:用________与_________,体积比___:___,温度_____,用______控制温度,此仪器如何放置__________。温度过低,则________,温度过高,则______,此时会闻到______气味,原因是_____
_________________。反应前预先要在烧瓶内加一些______,以防止_______。反应化学方程式:________________________,装置图参看课本或材料,发生装置是属___________________。
3、乙炔:分子式_______,结构简式________。
它的俗名________,________结构,结构式_________。物性:____色____味_____,___溶于水,密度比空气_____。
化性:(1)氧化A、使____________褪色;
B、与O2(现象:____________)______________________________。
(2)加成(与卤素、H2、卤化氢等)A、与Br2反应:___________________
B、与HCl____________________,
氯乙烯聚合_______________________。 用途:__________。
实验室制法;用____和___反应,化学方程式:______________________,装置图参看课本或材料,发生装置是属______________。
4、苯:分子式_______,结构简式________。
它是________结构。物性:____色____味_____,___溶于水,密度比水_____。补充:CCl4的密度比水_______。化性:(1)取代:A、与液(纯)溴,反应式:____________________,与溴水是否会反应?原因___________________。B、硝化________________________。(2)加成:与H2____________________
(3)与O2(现象:________),方程式:_______________________________
(4)苯是否会使酸性高锰酸钾溶液褪色__________。用途____________。
5、(理)甲苯:分子式_______,结构简式________。二甲苯分子式_______,结构简式________。化性都与____相似,有一些不同,如甲苯、二甲苯都可使_____________褪色,原因_____________。甲苯硝化________________。
三、同系物、同分异构体、同素异形体、同位素和同一物质之间的区别
1、同系物:_____相似,分子组成相差一个或若干个______原子团的化合物。
举例:
2、同分异构体:_______相同,______不同的化合物。
举例:
3、同素异形体:______元素组成的不同______。
举例:
4、同位素:_______相同、_______不同的同一元素的原子。
举例:
5、同一物质:_______和_______都相同的物质。
举例:
第十二单元 烃的衍生物
一、烃的衍生物的重要类别和代表物
(理)卤代烃:通式______,官能团_______,代表物:溴乙烷,分子式:_____,分子结构特点C-X键有极性,易断裂。化性:(1)取代:与NaOH________
______________________(2)消去:__________________________________。
检验卤代烃含卤原子的方法:先加_______溶液,取上层清液再加_______,最后滴入_______,发现有______产生即可。
1、醇:定义:______或______。通式:________。乙醇分子式_______,结构简式_______,俗名_______。密度比水_____,_____溶于水,溶解_____与______,更易溶________。医疗酒精体积分数为_____。甲醇_____,分子式______结构简式_____,__毒。 官能团:(醇羟基)______。
(理)乙二醇分子式_________丙三醇(甘油)分子式_________。物性:都为___色_____味、____性,用途:乙二醇作为________,甘油作为_________。
化性:(1)与Na反应:____________________
(2)氧化:A、燃烧:____________________B、催化氧化________________。
(3)消去反应:____________________________(4)与酸发生酯化(取代)反应。
2、酚:苯酚分子式________,结构简式________,俗名_______,_____溶于水。在空气中易被氧化成______色。官能团:(酚羟基)________,可电离出______离子。苯酚电离方程式:________________________。
化性:(1)弱酸性:与NaOH________________________________;
(2)取代反应:(与Br2)________________________________________。
(3)能使________________褪色;(4)检验:加FeCl3,呈______色。
3、醛:通式________,乙醛分子式,结构简式_________,______溶于水。甲醛:俗名_______,甲醛水溶液又称________,用途_____________。
官能团:_________,具有______性,属不饱和基团。
化性:(1)加成:与H2 ___________________________
(2)催化氧化:A、与O2_________________________________。
B、银镜反应:________________________________________________。
C、与新制氢氧化铜反应:_________________________________________。
4、羧酸:乙酸:分子式________,结构简式__________。俗名______或_____。
无水乙醋又叫________。____溶于水。官能团________,可电离出____离子,属饱和基团。
化性:(1)酸的通性,电离方程式:_____________________
(2)酯化(取代)反应:_____________________________________________。
5、酯:通式_________。乙醇乙酯:分子式________,结构简式_________。
______溶于水,有_____味。官能团:________,不算团,属饱和基团。
化性:水解:(1)与水________________________(2)与NaOH______________
二、烃的衍生物的转化关系:(分析断键位置)
醇R-OH
醛R-CHO
羧酸R-COOH
酯RCOOR,
三、溶解性
1、有机与无机_____溶;2、苯溶_____,不溶_____;3、醇、醛、酸一般___溶于水;4、乙醇几乎____溶所有_____和_____,更易溶______;5、相似相溶:_____________;6、萃取(物变):_____________。
四、反应类型与官能团的关系(以下横线填写官能团或结构符号)
1、加成:______、_______、_______、__________。
2、氧化:一般有机物的燃烧(与_____反应)、_______、_______。
3、酯化:______、_______。
4、水解:______、_______。
5、银镜或新制Cu(OH)2:_________。
五、官能团的电离:_________基与_________基可部分电离出____离子。
(理)掌握有关有机物分子式的确定的有关计算参看理书P55具体格式按照上课笔记。
第十三单元 糖类 油脂 蛋白质
一、糖类
1、单糖:代表物:葡萄糖,分子式_____,结构简式_________________,____溶于水,属_______醛,有1个______基,有5个_______基。
化性:(1)_____性:可发生银镜或新制氢氧化铜反应;(2)在酒化酶作用下可发酵生成______和_______;(3)____水解。 用途:____________________。
2、二糖:代表物:蔗糖、麦芽糖的分子式都为________,都____溶于水,但蔗糖分子结构中____醛基,____还原性,它在催化剂作用下水解生成______和______。而麦芽糖,分子结构中____醛基,_____还原性,它在催化剂作用下水解生成__________。这两种二糖的关系___________。形象记忆:_______有醛基。
3、多糖:代表物:淀粉、纤维素,分子式________,两者的关系:_____
都___溶于水,都属_________化合物。分子结构中都_____醛基,_____还原性。其中淀粉______羟基,而纤维素_____羟基(__个),可发生_______反应。两者都可以在一定条件下水解生成_______。其中淀粉水解一般是_______水解,为了证明这点,要用_____试剂来证明,这种试剂遇淀粉会变____色。
二、油脂:分为油(___态)例:___________;脂肪(____态),例___________。
它是由___________和_______形成的酯。
化性:(1)不饱和油脂氢化(硬化、加成)(2)油脂在___或____或______存在的条件下可发生水解。
用途:制肥皂,油脂与______发生的水解反应,又称为______反应。
三、蛋白质:溶解性:有的____溶,有的____溶。属__________化合物。
化性:(1)盐析:所加试剂为_____盐类,如_______________;
(2)变性:是否可逆_________。举例__________________________;
(3)颜色反应:加入________,呈_____色,可用来检验蛋白质;
(4)灼烧有__________气味; (5)水解成_________;
(6)具有___性,与酸、碱都可反应,分子结构中含有官能团______和_______。