湖南省示范性高中2006届高三联考试卷(化学)
命题人:株洲市二中 高三化学备课组
第Ⅰ卷(选择题,共15小题。共45分。)
本卷共15题,每题3分。在下列各题的四个选项中,只有一个选项是最符合题目要求的。
一、选择题:本大题共有15小题,每小题3分,共45分。每题只有一个正确答案。
1.下列叙述正确的是
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间主要通过氢键作用有规则排列成的分子晶体
D.液态氧化钠和铜导线的导电原理是相同的
2.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子
C.1.8g重氧水(H218O)含有NA个中子
D.84gNaHCO3晶体中含有NA个CO32-
3.下列递变规律正确的是
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的还原性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
4.2000年1月底,罗马尼亚—金矿污水处理池因降暴雨而发生裂口,10万升含氰化物和铅、汞等重金属的污水流入蒂萨河,造成该河90%以上的动植物死亡。这是继切尔诺贝利核泄漏以来,欧洲最严重的环境污染事件。氰气[(CN)2]和氰化物都是剧毒性物质,氰分子
的结构式为N≡C—C≡N,性质与卤素相似,下列叙述错误的是
A.氰分子中四个原子共直线,是非极性分子
B.氰分子中C与N之间的距离大于C与C之间的距离
C.氰气能与强碱溶液反应得到氰化物和氰酸盐
D.氰化氢在一定条件下能与烯烃发生加成反应
5.下列离子方程式中,正确的是
A.向氯化亚铁溶液中通入氯气
Fe2++Cl2=== Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应
Fe3++3NH3·H2O === Fe(OH)3↓+3NH4+
C.碳酸氢钙溶液跟稀硝酸反应
Ca(HCO3)2+2H+=== Ca2++2H2O+2CO2↑
D.氯气通入冷的氢氧化钠溶液中
2Cl2+2OH- === 3Cl-+ClO-+H2O
6.用惰性材料作电极,分别电解下列物质,当通过相同电量时,下列指定的电极上析出气体质量最大的是
A.NaOH溶液(阴极) B.NaCl溶液(阴极)
C.熔融的NaCl(阳极) D.Na2SO4溶液(阳极)
7.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx
与NaClO的物质的量之比为1:16,则X的值是
![]() A.2 B.3
C.4 D.5
A.2 B.3
C.4 D.5
8.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡
时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡
混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
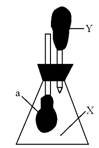 9. 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能是
9. 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能是
A. X是NH3,Y是水
B. X是CO2,Y是稀硫酸
C. X是SO2,Y是NaOH溶液
D. X是HCl,Y是NaNO3稀溶液
图
10. .已知在1×105Pa,298K条件下,2mol氢气完全燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) △H=+242kJ·mol-1
D.H2O(g)= H2(g) +1/2O2 (g) △H=+242kJ·mol-1
11.下列事实中能证明氯化氢是共价化合物的是
A. 氯化氢极易溶于水 B. 液态氯化氢不导电
C. 氯化氢不易分解 D. 氯化氢的水溶液能导电
12. 将一定体积的空气通入吸收剂,并测定其导电性的变化,这种方法可以测定空气中有害气体的含量。例如测定空气中Cl2的含量,若用NaOH溶液作吸收剂就不如用Na2SO3溶液作吸收剂灵敏度高。现用上述方法测定空气中H2S的含量,应选用的最佳试剂是
A. CuSO4溶液 B溴水 C水 DNaOH溶液
13.常温下,某水溶液中含有的离子浓度为c(Na+)=xmol/L、c(SO42-)=0.15mol/L、c(K+)=0.2mol/L、c(Cl-)=0.45mol/L、c(Mg2+)=0.25mol/L、c(NO3-)=0.25mol/L、c(OH-)=10-13mol/L.则x值为
A.0.2 B.0.3 C.0.4 D.0.1
14. 若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO-3 Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH+4 SO42- NO3-
15. 第三周期元素R,它的原子最外电子层上达到饱和所需电子数小于次外层和最内层电子数之差,但等于最内层电子数的正整数倍。下列说法正确的是
A. 常温下,能稳定存在的R的氧化物都能与烧碱溶液反应
B. R的最高价氧化物对应的水化物都是强酸
C. 在固态时,R的单质属于同一类型的晶体
D. 在常温下,R的气态氢化物都能在空气中稳定存在
第Ⅱ卷(非选择题,共6小题。共55分。)
16.(3分)下列操作或发生事故时的处理方法错误的是 (填字母)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH
B.称取一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线.
D.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
17.(10分)有三种常见的A、B、C短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:

请回答:
(1)写出C元素的原子结构示意图 ,写出丁和戊的电子式 、
;
(2)丙溶液呈碱性的原因(用离子方程式表示) ;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁 ;
②己溶液+丙溶液→丁 。
18.(14分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
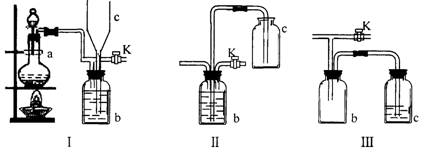
试回答:
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是__________________________检查的简单方法是__________________________
(2)装置[1)中b能防止多余气体逸散的原因是:____________________________
(3)欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) ______________ 理由是___________________________
[Ⅲ]是否可行(填“是”或“否”) _____________理由是______________
19. (10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
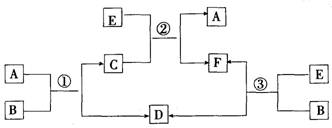
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 ,其中A的化学式是 。
(2)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的离子方程式是 。在反应③中,若生成1 molD,则转移电子数目为 。
20.(10分) 有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质.
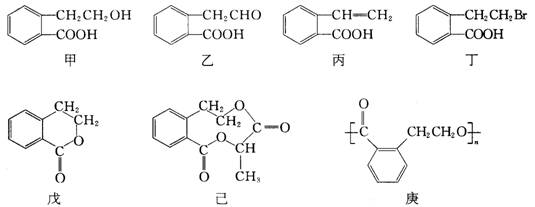
请回答下列问题:
(1)指出反应的类型:
甲→丙:______________________,甲→丁:______________________.
(2)在甲~庚七种物质中,互为同分异构体的是______________________(填代号,多选扣分,下同);可看作酯类的是______________________.
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有原子有可能都在同一平面内的物质是______________________.
21.(8分)某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:
(1)称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mLCO2气体(标准状况)。
(2)另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO2112mL(标准状况)和0.45g水。
试通过计算,确定天然碱的化学式。
化学参考答案
16.AC
17.(1) 略 ![]() (2)CO32-+H2O HCO3-+OH-
(2)CO32-+H2O HCO3-+OH-
(3)2H++CO32-=H2O+CO2↑;
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
18. (1)饱和食盐水;装置漏气;用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (涂肥皂水等合理方法均可)
(2)关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。
(3)是,原理与装置I同
否,c瓶因密闭,体积不能改变,压强增大时有危险
19. (1)EAD Br2
(2)3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
(3)2Na2O2+2H2O=4Na++4OH-+O2↑, 2NA
20.(1)消去 取代(卤代)
(2)丙与戊 戊、已、庚
(3)丙
![]() 21.已知CO2和NaOH反应的产物可能有Na2CO3、NaHCO3或二者的混合物。题中两次实验产生CO2体积关系,可以推知天然碱中含有Na2CO3、NaHCO3成分。
21.已知CO2和NaOH反应的产物可能有Na2CO3、NaHCO3或二者的混合物。题中两次实验产生CO2体积关系,可以推知天然碱中含有Na2CO3、NaHCO3成分。
根据反应:2NaHCO3 Na2CO3+H2O↑+CO2↑
样品中:n(NaHCO3)=2n(CO2)=2×![]() =0.01mol
=0.01mol
n(H2O)=0.5×0.01mol×18g/mol=0.09g(2分)
则样品中n(Na2CO3)=![]() -0.01mol=0.02mol
-0.01mol=0.02mol
结晶水:n(H2O)=![]()
所以,天然碱的化学式为:2Na2CO3·NaHCO3·2H2O(1分)